作者:鬼谷藏龍
編輯:小柒
提到狂犬病,很多人都會立刻回想起小時候被村頭惡犬支配的恐懼,如果不小心被咬傷,都會第一時間沖向醫(yī)院打狂犬疫苗。這樣的恐懼也不無道理,畢竟狂犬病的致死率一直居高不下:一旦被病犬咬傷,不加以處理的話就會有一定概率發(fā)病。
進入人體的狂犬病毒會精確地找到神經(jīng)細胞,順著神經(jīng)纖維一路“爬”到腦部進行大量增殖。不消幾個月,人就會出現(xiàn)各種并發(fā)癥,最終喪失心智在狂亂中死去(可以說只要發(fā)病基本就無力回天了)。
通過研究,科學(xué)家們關(guān)注到,狂犬病毒在感染過程中偏愛對 神經(jīng)細胞“下毒手” ,有很強的 特異性 。而人體內(nèi)的細胞如恒河沙數(shù),狂犬病毒是如何做到精準(zhǔn)排查神經(jīng)細胞并“定點打擊”的呢?
原來,狂犬病毒表面含有一系列識別蛋白,其中一種叫做 “狂犬病毒糖蛋白29” ,簡稱為RVG29。就是這種“開了掛”的蛋白,不但可以確保狂犬病毒精確地進入神經(jīng)細胞內(nèi)部,還能幫助狂犬病毒突破血腦屏障抵達腦部!
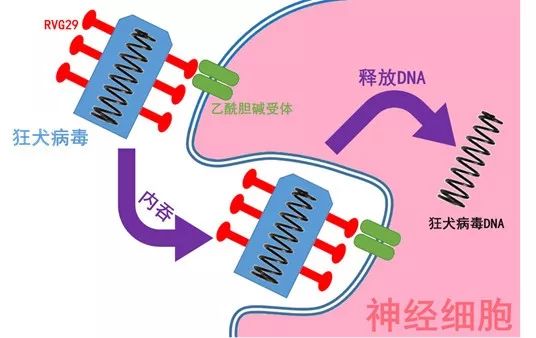 (狂犬病毒運作示意圖,狂犬病毒通過表面糖蛋白與神經(jīng)細胞表面的乙酰膽堿受體結(jié)合,從而向細胞內(nèi)釋放自己的DNA,并在神經(jīng)細胞中“生產(chǎn)”大量新的狂犬病毒。作圖:鬼谷藏龍。)
(狂犬病毒運作示意圖,狂犬病毒通過表面糖蛋白與神經(jīng)細胞表面的乙酰膽堿受體結(jié)合,從而向細胞內(nèi)釋放自己的DNA,并在神經(jīng)細胞中“生產(chǎn)”大量新的狂犬病毒。作圖:鬼谷藏龍。)
這個蛋白對于狂犬病毒來說就好比“開啟人腦的金鑰匙”,那么,反過來想,這把神奇的“鑰匙”能不能被人類所用,治療神經(jīng)疾病呢?
給大腦“送快遞”
最近,來自中國科學(xué)院等三個機構(gòu)的研究者們,就從狂犬病的致病機制中得到靈感,發(fā)明了一種可以把藥物精確傳送到大腦中的納米顆粒。
他們的設(shè)計簡單來說就像是 “送快遞” 。
要送快遞,首先得先把東西包裹起來。狂犬病毒本身毒性太大肯定不能直接拿來用,研究人員將目光轉(zhuǎn)向納米技術(shù)。他們利用一種 “雙重乳化” 技術(shù)制作出了一種空心的納米顆粒,可以將藥物包裹在其中。而且這些納米顆粒被設(shè)計成一種在細胞外面非常穩(wěn)定,只有進入細胞內(nèi)部才會釋放出內(nèi)在藥物的形式。
有了“快遞包裹”,就該準(zhǔn)備發(fā)貨了!于是,研究者們接下來利用一些化學(xué)手段把RVG29“安裝”到他們設(shè)計的納米顆粒表面,這就相當(dāng)于是給快遞包裹上寫好了送貨地址(腦神經(jīng)系統(tǒng)總部),這快遞就能送出去了。
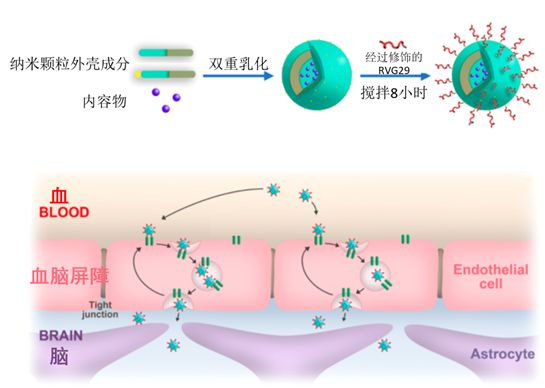
(納米顆粒的示意圖,圖片來源:參考文獻[1],略有改動。)
所謂大膽假設(shè),小心求證。為了測試這樣的納米顆粒是否真能精確靶向神經(jīng)細胞,研究人員們先在這種納米顆粒當(dāng)中包入特殊的熒光染料,然后在體外模擬了人體的血腦屏障,看看這些納米顆粒能否突破人造血腦屏障,將熒光染料送到體外培養(yǎng)的神經(jīng)細胞當(dāng)中。
結(jié)果證實,帶有RVG29的納米顆粒真就很輕松地就讓那些被隔離在人造血腦屏障之中的神經(jīng)細胞發(fā)出了強烈的熒光。

(圖為體外模擬結(jié)果,直接加染料幾乎無法透過血腦屏障(第一列,對照組),而一般的納米顆粒(第二列)效果遠遠不如帶有RVG29的納米顆粒(第三列)的穿透效果好,而如果再加入游離的RVG29蛋白,那么這些游離RVG29會和納米顆粒競爭對應(yīng)的細胞受體,所以導(dǎo)致納米顆粒穿透血腦屏障能力下降。圖片來源:參考文獻[1])
不過體外模擬畢竟和真實的生物體內(nèi)環(huán)境不太一樣,于是他們又把包含熒光染料的納米顆粒注射進了小鼠體內(nèi),結(jié)果帶有RVG29的納米顆粒相比于一般的納米顆粒可以讓染料進入小鼠腦子的效率提升三倍左右。
帕金森病小鼠的治療試驗
有了這些前期試驗,科學(xué)家們就有底氣“動真格”了!這一回,他們選擇了帕金森病作為測試的對象。
帕金森病是最常見神經(jīng)退行性疾病之一,它的發(fā)病是由于大腦黑質(zhì)中的多巴胺能神經(jīng)元大量死亡導(dǎo)致的。有人發(fā)現(xiàn),這些神經(jīng)元死亡之前會出現(xiàn)一種鐵離子濃度異常升高的現(xiàn)象,如果 設(shè)法控制住這些神經(jīng)元當(dāng)中的鐵離子濃度,就能有效避免它們的死亡。

(在達沃斯世界經(jīng)濟論壇上的64歲的穆罕默德·阿里。阿里從38歲起即有帕金森病的癥狀,直至其逝世。圖片來源:wikipedia)
因此,帕金森的療法中就有一類是依靠降低病人腦部的鐵離子濃度來實現(xiàn)的。醫(yī)生會利用類似“去鐵胺”(deferoxamine)等螯合劑,這些物質(zhì)能像“吸鐵石”一樣吸走細胞里的鐵離子。但是這種療法有很大副作用——雖說鐵離子對神經(jīng)元來說是個禍害,但對于人體其它組織細胞又不可或缺。
如果直接把去鐵胺注入人體,就會橫掃路遇的一切鐵離子,把人全身上下都吸個遍。而與此同時,因為“血腦屏障”的存在,真正能進入腦部的去鐵胺少之又少。因此以往的使用去鐵胺的療法通常弊大于利。
而這項研究就把去鐵胺包裹在了納米顆粒當(dāng)中,并用于對藥物誘導(dǎo)的帕金森病小鼠進行治療試驗。結(jié)果表明, 經(jīng)過治療的小鼠無論是帕金森病的外在癥狀還是一些體內(nèi)的生理指標(biāo)都有了非常明顯的提升 。雖然仍和健康小鼠還有些許差距,不過生活狀況可以說是有了明顯的改善。
當(dāng)然必須要說明的是,這種技術(shù)距離真正上臨床治療帕金森病或是其它中樞神經(jīng)系統(tǒng)疾病可能還需要時間,但此項研究無疑是推出了一種新的納米技術(shù)。
如果說新療法的出現(xiàn)是一條漫漫長征,這種技術(shù)還只能說是邁出了前途未卜的第一步。無論怎樣,對于艱辛的藥物研發(fā)之路來說,多一個新的方向也總歸不是壞事。

作者名片

排版:小爽
題圖來源:Pixabay
參考文獻:
1. Targeted Brain Delivery of Rabies Virus Glycoprotein29-Modified Deferoxamine-Loaded Nanoparticles Reverses Functional Deficits inParkinsonian Mice. Linhao You, Jing Wang, TianqingLiu, Yinlong Zhang, Xuexiang Han, Ting Wang, ShanshanGuo, Tianyu Dong, Junchao Xu, Gregory J. Anderson, QiangLiu, Yan-Zhong Chang, Xin Lou, and Guangjun Nie. ACS Nano 2018 12 (5),4123-4139. DOI: 10.1021/acsnano.7b08172

為了給大腦運藥,科學(xué)家們竟從狂犬病毒那里“取經(jīng)”?
圖文簡介
狂犬病毒是如何做到精準(zhǔn)排查神經(jīng)細胞并“定點打擊”的呢?
- 來源: 我是科學(xué)家
- 上傳時間:2018-09-07


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助