銅位于元素周期表第四周期IB族,是人類最早使用的金屬。銅具有優異的性能,已被廣泛應用于工業領域。銅在地殼中的含量約為0.01%,在自然界中,銅多以化合物狀態存在。常見的銅礦石有黃銅礦(CuFeS2)、輝銅礦(Cu2S)、孔雀石(Cu2?(OH)2CO3)、赤銅礦(Cu2O)、膽礬(CuSO4·5H2O)等。
西漢時期,劉安所著的《淮南萬畢術》中有“曾青得鐵則化為銅”的記載,其含義是把鐵片放入硫酸銅溶液或其它銅鹽溶液中,可以置換出單質銅,這種方法就是現代濕法冶金的先驅。濕法煉銅也稱膽銅法,其生產過程主要包括兩個步驟,一是浸銅,把鐵放在膽礬的溶液中,使膽礬中的銅離子被鐵置換成單質銅沉積下來;二是將置換出的銅粉收集起來,再加以熔煉。濕法冶銅的本質原理是利用金屬性比銅強的物質置換比它弱的金屬(K、Ca、Na除外),例如在硫酸銅溶液中加入金屬鋅或鐵,可置換得到金屬銅,主要反應為:CuSO4+Zn=Cu+ZnSO4;CuSO4+Fe=Cu+FeSO4。
世界濕法冶銅第一人張潛,結合前人著作和個人經驗撰寫了《浸銅要略》一書,書中記述利用含銅礦水(或稱膽水)冶銅的技術,此書所述膽銅法具有“用費少而收功博”的優點。
在化學實驗室中,我們也可以模擬濕法冶銅。取20cm長的鐵絲用砂紙打磨光亮,再取4ml硫酸銅溶液于試管中,加入打磨光亮的鐵絲,靜置,可以觀察到鐵絲表面有紫紅色金屬析出,并且溶液逐漸由藍色變為淺綠色。析出的紫紅色金屬就是銅,最后取出鐵絲,收集鐵絲表面析出的銅。
除此之外,我國古代還有一種冶煉銅的方法——“火法煉銅”。據考證,商代的火法煉銅,主要是用孔雀石和木炭。火法冶銅是將含有銅元素的氧化物與還原劑在較高溫度下進行反應制取單質銅的過程,此還原反應需要一定的溫度,所以要在加熱的狀態下才能產生銅單質,故稱為“火法冶銅”。
人類很早就發現孔雀石通過灼燒后,會產生一種紅色光亮的金屬,這種金屬就是銅。孔雀石的主要成分是堿式碳酸銅[Cu2(OH)2CO3],堿式碳酸銅受熱會分解生成氧化銅、水和二氧化碳,碳或一氧化碳具有還原性,可以還原氧化銅,產生的反應為:Cu2(OH)2CO3 △ 2CuO+H2O+CO2 ↑;C+2CuO高溫?2Cu+CO2 ↑;CO+CuO△ Cu+CO2 。
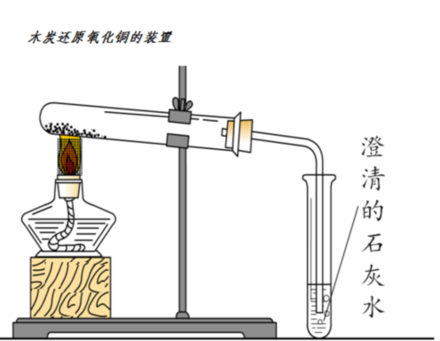
在化學實驗室里,我們可以利用如下圖所示的裝置來模擬火法冶煉。稱取10g新制氧化銅,研磨成粉末,倒入坩堝中充分烘干。再稱取1.5g新制木炭,同樣研磨成粉末,倒入坩堝中充分烘干。然后將氧化銅粉末和木炭粉末混合均勻,用藥匙或紙槽平鋪在試管底部,按下圖所示組裝儀器,將玻璃導管的一端伸入盛有澄清石灰水的試管中,用帶防風罩的酒精燈加熱。當澄清的石灰水變渾濁,試管中逐漸出現紫紅色或紅色固體后停止加熱。反應完成之后,先撤出伸入盛有澄清石灰水試管的玻璃導管,再撤出酒精燈。最后將試管中的粉末倒在一張干凈的白紙上,將粉末攤開后觀察,會發現紙上有紫紅色的固體,這就是銅。
審核人:李繼良

本作品為“科普中國-科學原理一點通”原創,轉載時務請注明出處。


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助