8月29日,來自日本大阪大學(xué)研究團隊利用iPS(induced pluripotent stem cells)細胞誘導(dǎo)而成的角膜組織,令一位因角膜病變遭受失明困擾的女性患者重見光明。這項先端研究由大阪大學(xué)醫(yī)學(xué)院西田幸二教授率領(lǐng)的團隊完成,該手術(shù)于7月進行,患者已于8月23日康復(fù)出院。這項研究帶來的成果有望在未來解決角膜供體不足的問題,令更多患有相關(guān)疾病的患者重獲新生。那么,除了被分化為角膜組織,iPS細胞還有哪些令人期待的醫(yī)學(xué)用途呢?
成熟體細胞“重造”,變身多能干細胞
iPS細胞,被稱人工多能干細胞,是從人的皮膚等體細胞,經(jīng)過多能性誘導(dǎo)因子的導(dǎo)入、培養(yǎng)所制成的具有分化成人體各種組織臟器并具有無限增殖能力的細胞。
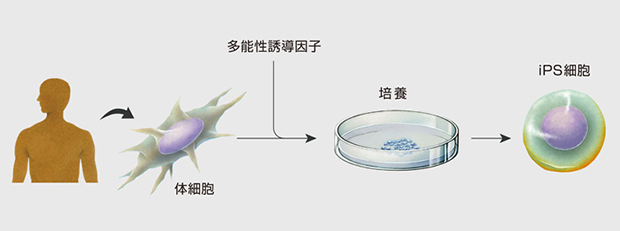
iPS制作概要
圖片來源:https://www.cira.kyoto-u.ac.jp/j/faq/faq_ips.html
iPS細胞最初于2006年由日本京都大學(xué)山中伸彌教授制作成功,它的發(fā)現(xiàn)成為了解決不少疑難罕見疾病的新希望,引起了全世界的廣泛關(guān)注。山中教授也因此于2012年獲得了諾貝爾生理學(xué)醫(yī)學(xué)獎,并在京都大學(xué)成立了世界首個iPS研究所。

京都大學(xué)iPS研究所,來源:研究所官網(wǎng)
利用iPS探索骨罕見病新藥物
肌肉骨化病又稱進行性肌肉骨化癥 ( Fibrodysplasia ossificans progressiva, FOP),是世界范圍內(nèi)的罕見病之一。全球病例數(shù)不超過千人,日本全國只有80個患者,至今沒有發(fā)現(xiàn)有效的治療藥物。
該病患者的主要癥狀是肌肉里會形成多余的骨組織。從孩童時期開始,患者全身肌肉包括肌肉周圍的膜、肌腱以及韌帶等部位逐漸變硬鈣化。四肢肌肉鈣化將導(dǎo)致手腳關(guān)節(jié)活動范圍變窄以及手指彎曲,而脊椎骨鈣化將導(dǎo)致背部變形。最終,和呼吸相關(guān)的肌肉以及口腔肌肉出現(xiàn)鈣化骨化,導(dǎo)致患者進食困難和呼吸衰竭,最后在痛苦中走向死亡。
2018年11月2日,日本京都大學(xué)iPS(誘導(dǎo)多功能干細胞)研究小組報告稱,他們利用iPS細胞技術(shù)篩選出了幾種可能對此病有治療效果的候補藥物。相關(guān)研究也刊登在頂級期刊雜志Stem Cell Reports上。雖然宣稱人類戰(zhàn)勝這種疾病還為時尚早,但對于在痛苦中掙扎的患者而言,這項研究不啻為照進黑暗中的光芒。那么,研究人員是如何利用iPS發(fā)現(xiàn)這種疑難疾患的新藥物呢?
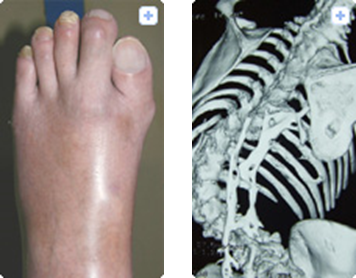
進行性肌肉骨化癥,伴隨的大拇指彎曲以及脊椎變形
圖片來源:http://fop.umin.jp/fop.html
通過對病因長達15年的研究,人們發(fā)現(xiàn)該疾病與ACVR1基因發(fā)生異常直接相關(guān)。該基因是位于常染色體上的顯性基因,由于實際發(fā)病的患者少有家族史,因此醫(yī)學(xué)界普遍認為多數(shù)病例是由不明原因的基因突變所引起。
研究人員首先利用含有變異型ACVR1基因的小鼠,對4892個可能有治療作用的藥物進行篩選,篩選出了有抑制肌肉鈣化傾向的7種化合物。其次,京都大學(xué)iPS研究小組利用肌肉骨化病患者的體細胞誘導(dǎo)出了iPS細胞,并如下圖所示利用iPS細胞的多功能分化能力,將其分化成間葉系間質(zhì)細胞,再將它進一步分化成成熟的軟骨細胞。研究者就利用這個原理,從上述的7種化合物中,發(fā)現(xiàn)了3種能有效抑制患者iPS細胞向軟骨細胞分化的化合物。
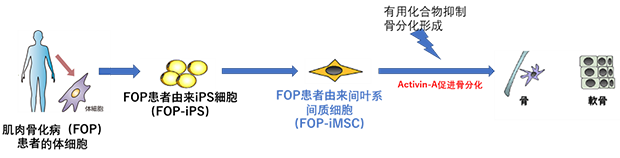
利用FOP患者由來的iPS細胞篩選化合物的流程圖 圖片來源:作者自制
最后,研究人員將肌肉骨化病患者iPS細胞分化成的間葉系間質(zhì)細胞,移植到免疫缺陷的小鼠腿部中,并對該小鼠腹腔注射上述3種化合物,每天一次,一周五次,持續(xù)8周。再通過X光和微型CT檢測小鼠腿部肌肉處是否有多余骨頭形成。
如下圖所示,最左側(cè)對照組小鼠的大腿肌肉上生出了多余的骨骼,但在右側(cè)兩種藥物的投與下,箭頭位置處的骨骼生成得到了有效的抑制。這項耗時3年的研究,是世界上首次利用iPS技術(shù)篩選抑制肌肉骨化藥物的成功嘗試。這兩種化合物要做作為治療人類疾病的藥物,還需要進行多次臨床試驗。不過,我們?nèi)匀豢梢宰院赖卣f,在肌肉骨化癥研究和治療領(lǐng)域,人類取得了重大突破。
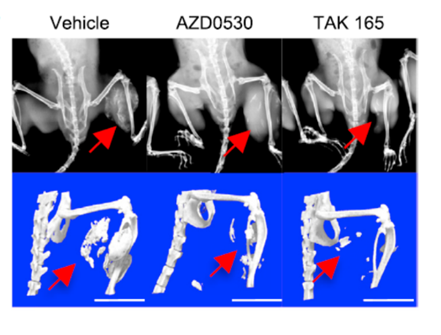
利用FOP-iPS小鼠模型檢測藥物抑制肌肉骨化的效果圖
圖片來源:https://doi.org/10.1016/j.stemcr.2018.10.007
能分善變,iPS搞定移植再生
除了利用iPS細胞建立藥物分析篩選模型,iPS還可以用于器官或者組織移植。接下來,我們將介紹如何通過iPS細胞進行軟骨缺損后的修復(fù)。
軟骨組織,由軟骨細胞和基質(zhì)組織構(gòu)成,在人體中大量存在于關(guān)節(jié)處。軟骨在遭到嚴重損傷后很難自我修復(fù)或再生,最終將很可能造成軟骨缺失的后果。如下圖所示,常見的軟骨缺失包括:
1. 后天關(guān)節(jié)軟骨缺失變性,由于長期的運動、外傷引起血流不暢、骨骼壞死進而導(dǎo)致骨和軟骨組織脫落分離,多發(fā)于運動員或者成長期的中小學(xué)生中。
2. 先天軟骨缺失,由于先天的原因?qū)е鲁錾鷷r身體某處缺少軟骨,如耳廓缺失造成的小耳癥。
由于人類缺乏軟骨修復(fù)能力,一旦發(fā)生損傷或缺失,患者的生活品質(zhì)將受到嚴重影響。目前主要通過組織移植來治療軟骨缺損。
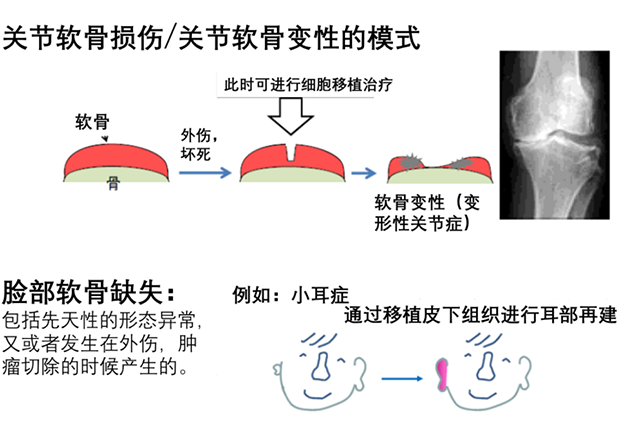
軟骨缺損疾病 圖片來源:http://www.jst.go.jp/ips-trend/symposium/pdf/no05/poster/ks_b04.pdf
以往的方法是將患者健康的軟骨組織提取后,體外進行擴大培養(yǎng)再移植到缺失處。但是這種方法往往引起軟骨細胞發(fā)生變性,生成纖維狀結(jié)構(gòu),造成移植效果不佳。如果移植效果不好,還需要進行新軟骨組織的采取,給患者身體造成傷害。
因此,是否可以不通過自組織移植來進行治療呢?京都大學(xué)iPS研究所妻木教授率領(lǐng)的骨組織移植研究小組,利用健康人的iPS細胞(注意不是患者的iPS細胞)分化成軟骨細胞,再進一步形成軟骨組織,最后將組織片移植到患者軟骨缺損處。該方法的好處是可以嚴格控制高品質(zhì)的移植用軟骨細胞,并且不需要患者自己的組織作為來源。目前研究人員們正在小鼠身上進行實驗。
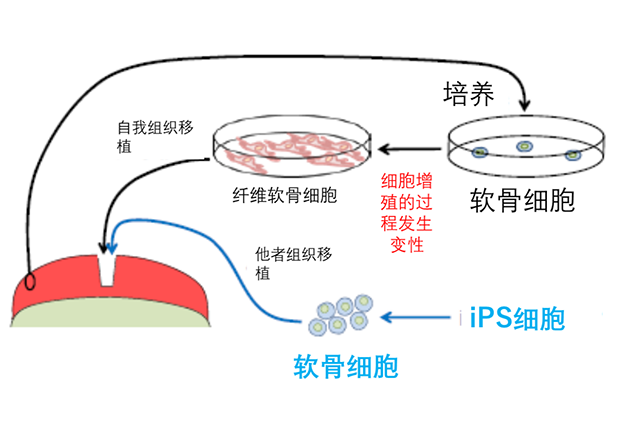
軟骨組織移植圖,黑線為傳統(tǒng)方式 圖片來源:http://www.jst.go.jp/ips-trend/symposium/pdf/no05/poster/ks_b04.pdf
在再生醫(yī)療領(lǐng)域,除了將iPS細胞用于軟骨疾病治療,研究者也嘗試了將iPS細胞分化成的心臟組織、胰腺組織、視網(wǎng)膜組織等。如下圖所示,該療法簡單來說就是由患者身上提取iPS細胞,在體外將其分化成心肌組織、角膜組織、神經(jīng)組織、血小板以及胰島等再將其移植回患者患部,最終彌補或者代替缺損組織。iPS療法為先天性心臟病和視網(wǎng)膜變性等疑難雜癥的治療提供了全新的視角,相關(guān)研究已經(jīng)取得了顯著的臨床療效。
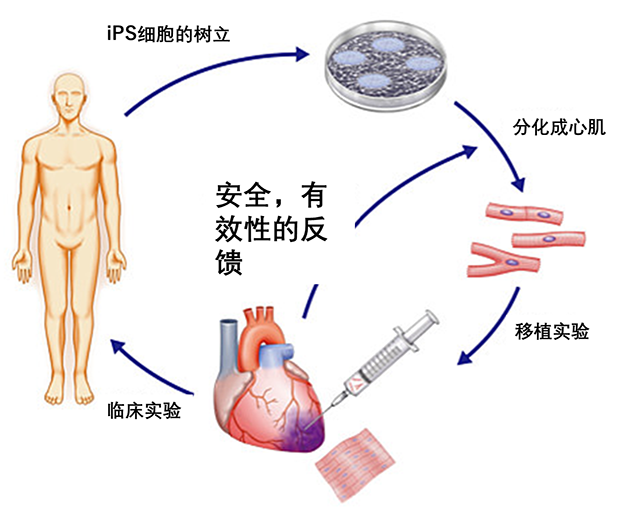
iPS細胞移植簡圖 圖片來源
http://www.cpnet.med.keio.ac.jp/research/basic/ips/
iPS細胞療法目前的最大難點是什么?
盡管iPS細胞的相關(guān)研究為未來醫(yī)學(xué)領(lǐng)域的巨大進步提供了新的希望,現(xiàn)在仍有很多難題等待科學(xué)家們攻克。
首先,從患者的皮膚細胞制作iPS細胞需要2個月的時間,再對這些iPS細胞進行分化,令其形成其他組織的流程同樣需要很長的周期。比如分化成角膜需要3個月,分化成胰島需要至少1個月。而患者的iPS細胞往往很敏感脆弱,和正常健康人相比,分化成組織細胞的成功率偏低。
其次,盡管用患者的iPS成功分化了組織細胞,如何再將這些細胞分化成具有合適功能的組織片(比如能產(chǎn)生胰島素的胰島細胞,能正常跳動的心肌組織等)仍然是需要持續(xù)研究的課題。
此外,患者iPS細胞不易得,因此目前大部分研究小組采用正常人的iPS細胞進行實驗,這些正常人的iPS能否移植到患者的體內(nèi),有沒有排異反應(yīng),如何克服排異反應(yīng)也是科學(xué)家致力研究的課題。
隨著科學(xué)研究的不斷進步和研究人員的持續(xù)努力,我們期待也相信iPS在難病罕見病的治療上能持續(xù)創(chuàng)造新的希望和奇跡。
參考文獻:
1. An mTOR Signaling Modulator Suppressed Heterotopic Ossification of Fibrodysplasia Ossificans Progressiva.
2. Dysregulated BMP signaling and enhanced osteogenic differentiation of connective tissue progenitor cells from patients with fibrodysplasia ossificans progressiva (FOP).


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助