導讀
近日,英國牛津大學(University ofOxford)Darren J. Dixon和荷蘭阿姆斯特丹自由大學(Vrije Universiteit Amsterdam)Trevor A. Hamlin課題組聯合報道了一種通過BIMP(bifunctional iminophosphorane)催化的張力釋放去共軛反應,高對映選擇性的實現了亞烷基環丙烷ACPs(alkylidenecyclopropanes)的簡易合成。通過對基礎催化劑體系的微調,該反應可拓展至含酯基、酰胺基、氧膦基和酮羰基等多種官能團的底物。通過設計特定底物并重新調控催化劑的亞氨基磷單元,該轉化還可成功應用于常見殺蟲劑氯菊酯的單一立體異構體及一系列環丙烷類殺蟲劑核心骨架的合成。文章鏈接DOI:10.1038/s41586-025-09485-y。
(圖片來源:Nature)
正文
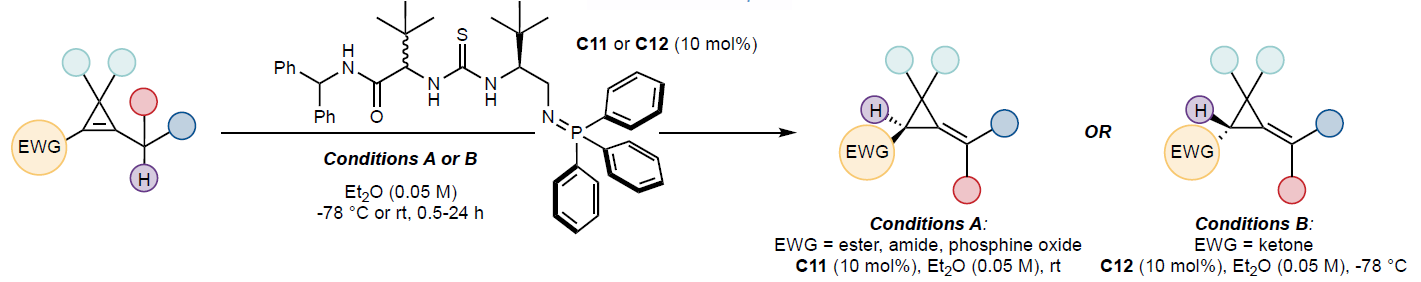
小環碳環化合物的對映選擇性構建一直是有機化學家面臨的持久挑戰。盡管ACPs這類小環碳環化合物具有重要的商業價值,但其對映選擇性合成路線仍有待進一步發展。值得注意的是,ACPs可轉化為環丙烷骨架,其廣泛存在于藥物分子(如抗新冠病毒藥物Nirmatrelvir 1)以及天然和合成農用化學品(如氯菊酯2)中。最近,英國牛津大學Darren J. Dixon和荷蘭阿姆斯特丹自由大學Trevor A. Hamlin課題組報道了一種通過BIMP催化的張力釋放去共軛反應,高對映選擇性的實現了ACPs的簡易合成。該轉化可應用于殺蟲劑氯菊酯及一系列環丙烷類殺蟲劑核心骨架的合成,具有重要的實用價值(Figure 1a)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
作者首先選擇測試底物3a進行研究(Figure 1b)。第一代BIMP催化劑(C1-C5)具有單一立體中心,能高效促進去共軛反應,以良好至優異的產率(68-98%)獲得目標產物。雖然產率普遍較高,但對映選擇性受堿強度影響顯著。催化劑C4表現出較好的對映控制(75% ee),而堿性更強的PCy3衍生亞氨基磷(C3)則無效(0% ee)。有趣的是,盡管氫鍵供體強度不同,硫脲催化劑C2(-49% ee)和脲類催化劑C4/C5(75%/67% ee)均能實現良好對映控制,且脲類催化劑平均產率更高。隨后作者研究了第二代BIMP催化劑(C6-C11),其在亞氨基磷遠端引入α-氨基酰胺基團以改善對映控制。單立體中心的C6對映選擇性較低(-11% ee),產率中等(52%);而引入第二立體中心(C7)將對映選擇性提升至42% ee,產率保持48%。通過增大近端立體中心R2的位阻可進一步提高選擇性。二苯甲基(C8)使對映選擇性達-63% ee,苯基(C9)提升至76% ee,叔丁基(C10)則達到81% ee。通常靠近亞氨基磷的立體中心決定產物絕對構型(S-中心得R-產物,反之亦然),但C6因缺乏次級立體中心影響催化劑構象而例外。最終作者采用PPh3衍生的亞氨基磷(C11)降低堿性,在乙醚溶劑中以0.05M濃度高效獲得3b(96%產率,95% ee)。
此外,作者還研究了α,β-不飽和酮類底物以拓展該反應的適用范圍(Figure 1c)。底物4a的對映選擇性控制和產物E/Z構型調控帶來了新挑戰。經過系統研究,作者發現C11的非對映異構體C12是該轉化的高效催化劑。底物4a在120分鐘內快速轉化為產物4b,并表現出優異的非對映選擇性(>20:1 d.r.),但對映選擇性控制完全失效,表明催化劑導致了酸性更強的酮體系外消旋化。通過縮短反應時間可有效挽救對映選擇性(120分鐘(0% ee)→5分鐘(24% ee)→0.5分鐘(65% ee))。最終在-78°C低溫條件下反應2小時,以99%產率、>20:1 d.r.和93% ee獲得ACP產物4b。
(圖片來源:Nature)
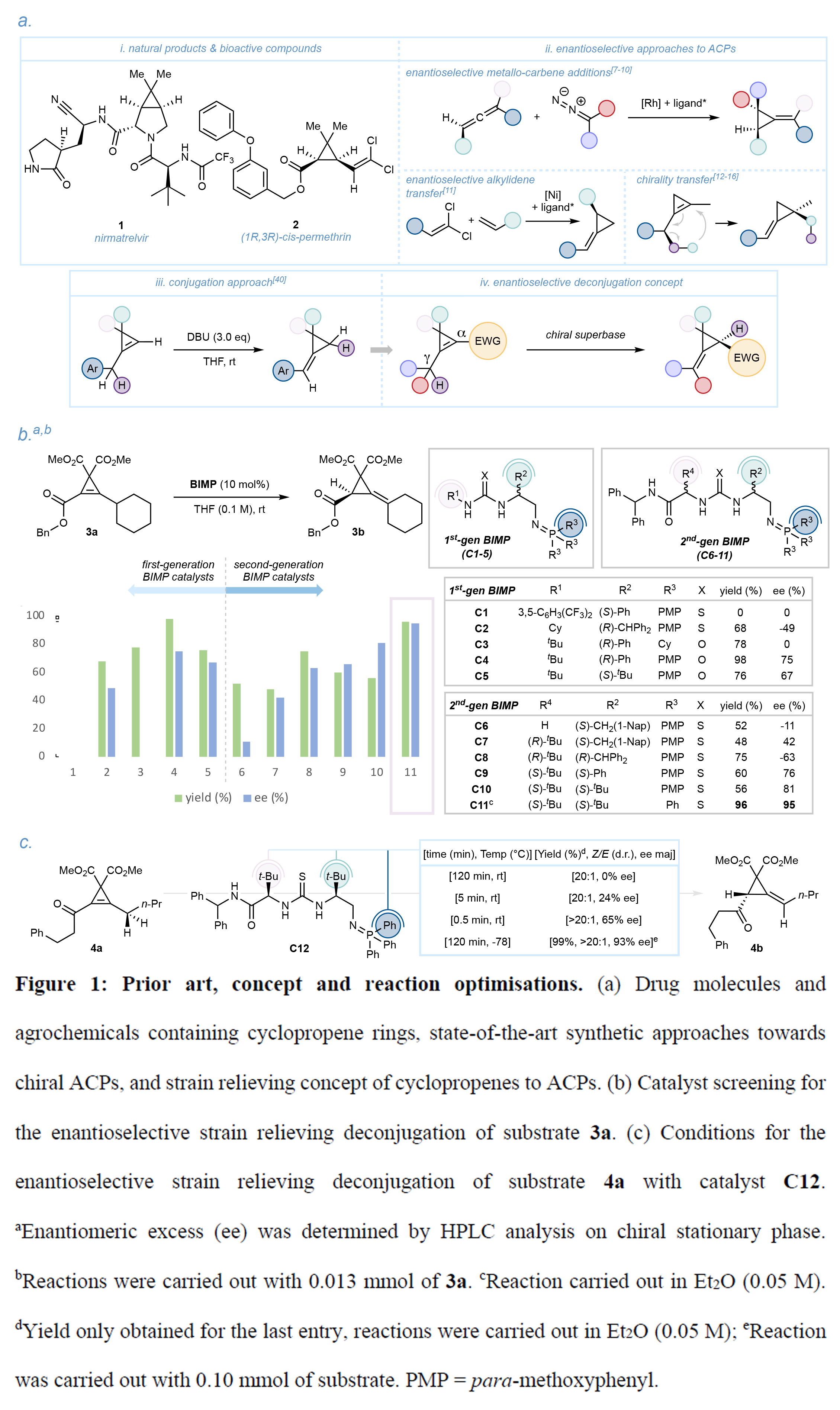
接下來,作者考察了該反應的底物適用范圍(Figure 2)。將環己基(3a)替換為環戊基(5a)時反應活性不受影響(96%產率),5小時內獲得產物5b(94% ee)。雜環體系同樣適用,產物6b和7b分別獲得95%和96% ee。烯丙酯底物8a也能高效轉化(75%產率,97% ee)。在C11催化下,含正丙基和芐酯的底物9a在30分鐘內轉化為9b,表現出優異的(Z)-構型選擇性(>20:1 d.r.)、95% ee和97%產率。由于α-質子的酸性,產物9b在反應條件下會逐漸外消旋化,其單晶X-射線衍射確認為(R)-構型。甲酯10b和異丁酯11b分別在2小時和3小時內形成,均保持優異的非對映(>20:1 d.r.)和對映選擇性(97%和94% ee)。
此外,作者還考察了各類官能化烷基鏈的兼容性。在低溫條件下,氯代烷基底物12b可以以79%產率和94% ee獲得單一非對映體。OTBS和苯基取代的底物(13b-14b,16b-17b)均能高效轉化,對映選擇性普遍超過90%,且多為單一非對映體。底物16a因TBS基團的位阻效應,非對映(89:11)和對映選擇性(86% ee)略有下降。針對環丙烯橋亞甲基碳的取代基效應,作者測試了四種酯類(Et、i-Pr、t-Bu、Bn)。盡管位阻增加,所有底物(18a-21a)均保持高產率和高對映選擇性。無酯基底物22a反應24小時后,仍可以以97%產率和90% ee獲得產物22b。
對于含酮基的底物23a,反應經質子轉移后進一步轉化為烯酮23b,以> 20:1 d.r.和98% ee精準構建三個立體中心。底物24a(含甲酯和乙基鏈)在30分鐘內轉化為24b(99%產率,>20:1 d.r.,90% ee),為理論計算研究提供了理想參照。作者在優化條件下對酰胺類底物進行了測試。叔丁酰胺25a因γ-質子酸性降低需1小時轉化,但仍保持>20:1 d.r.和98% ee;烯丙酰胺26b(2小時,73%產率,97% ee);環戊基酰胺27b(93%產率,99% ee,單晶確認R-構型且80小時內無消旋);對甲氧基苯基酰胺29a轉化為29b(>99%產率,94% ee),延長反應時間后可進一步環化為29c(>20:1 d.r.,97% ee)。此外,磷氧化物底物30a可以以95%產率和99% ee得到相應的產物。
接下來,作者使用催化劑C12來考察酮類底物范圍。環戊烷取代的31a(4小時,90%產率,99% ee)和對甲氧基苯基酮32a(97%產率,>20:1 d.r.,84% ee)均可實現轉化。雖對映選擇性略有下降,但仍表現出優異的非對映控制。
(圖片來源:Nature)
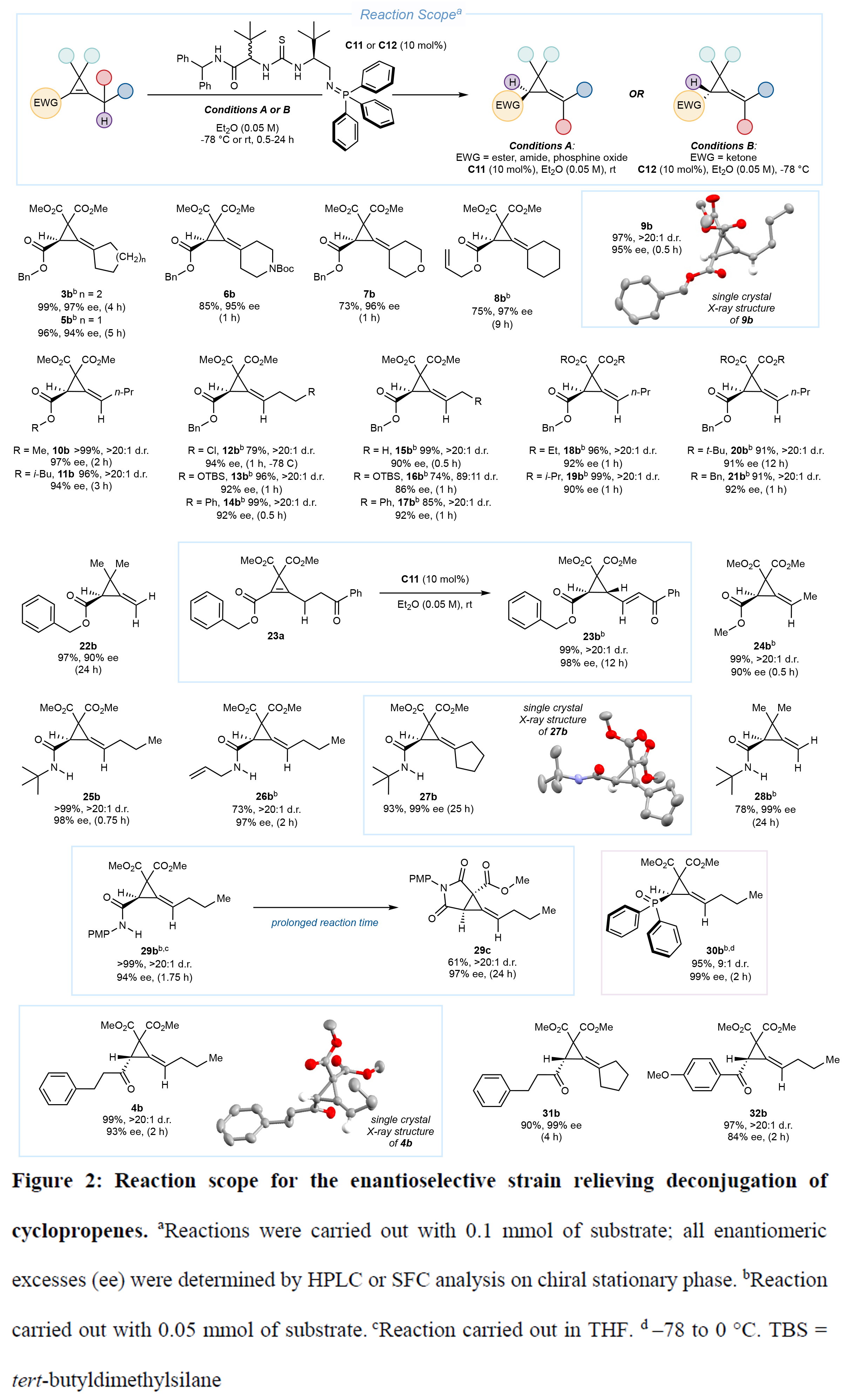
截至2020年,擬除蟲菊酯類殺蟲劑占全球殺蟲劑銷售額的25%,但目前其合成方法中直接對映選擇性手段仍十分有限。為實現這些結構在不對稱催化產物中的構建,作者設計了一種改良策略,其通過在去質子化位點引入醇保護基,促使雙鍵遷移形成烯醇醚,經脫保護后可獲得易于官能團化的醛類化合物,同時一步確立兩個立體中心(Figure 3)。采用該策略,底物33a經催化劑C13催化能以90%收率高效生成產物33b,并展現優異的非對映選擇性(>20:1)和對映選擇性(98% ee)。進一步應用該催化體系,作者成功完成了氯菊酯的六步不對稱全合成(98% ee),并拓展至七氟菊酯(35b)、四氟苯菊酯(36b)和聯苯菊酯(37b)等醛類前體的合成(>97% ee,1小時內)。該催化體系對非醚鏈類底物同樣有效,如橋環己基螺環丙烯38a能以> 20:1 d.r.和99% ee選擇性在2小時內轉化。此外,通過對39b的低溫DIBAL-H還原(收率44%,97% ee)和22b的立體選擇性環氧化(>20:1 d.r.,90% ee),驗證了該催化產物的衍生化潛力。
(圖片來源:Nature)
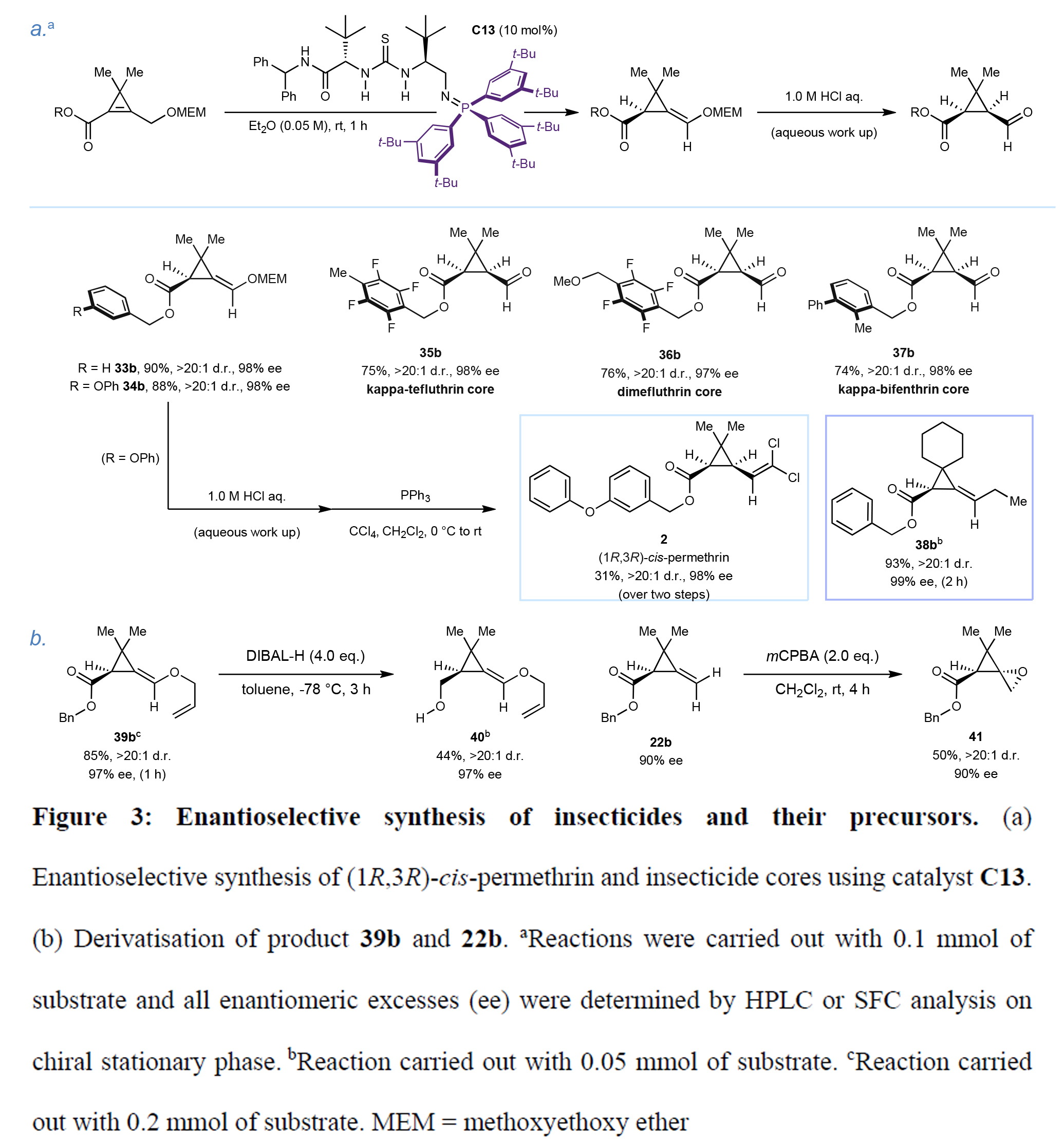
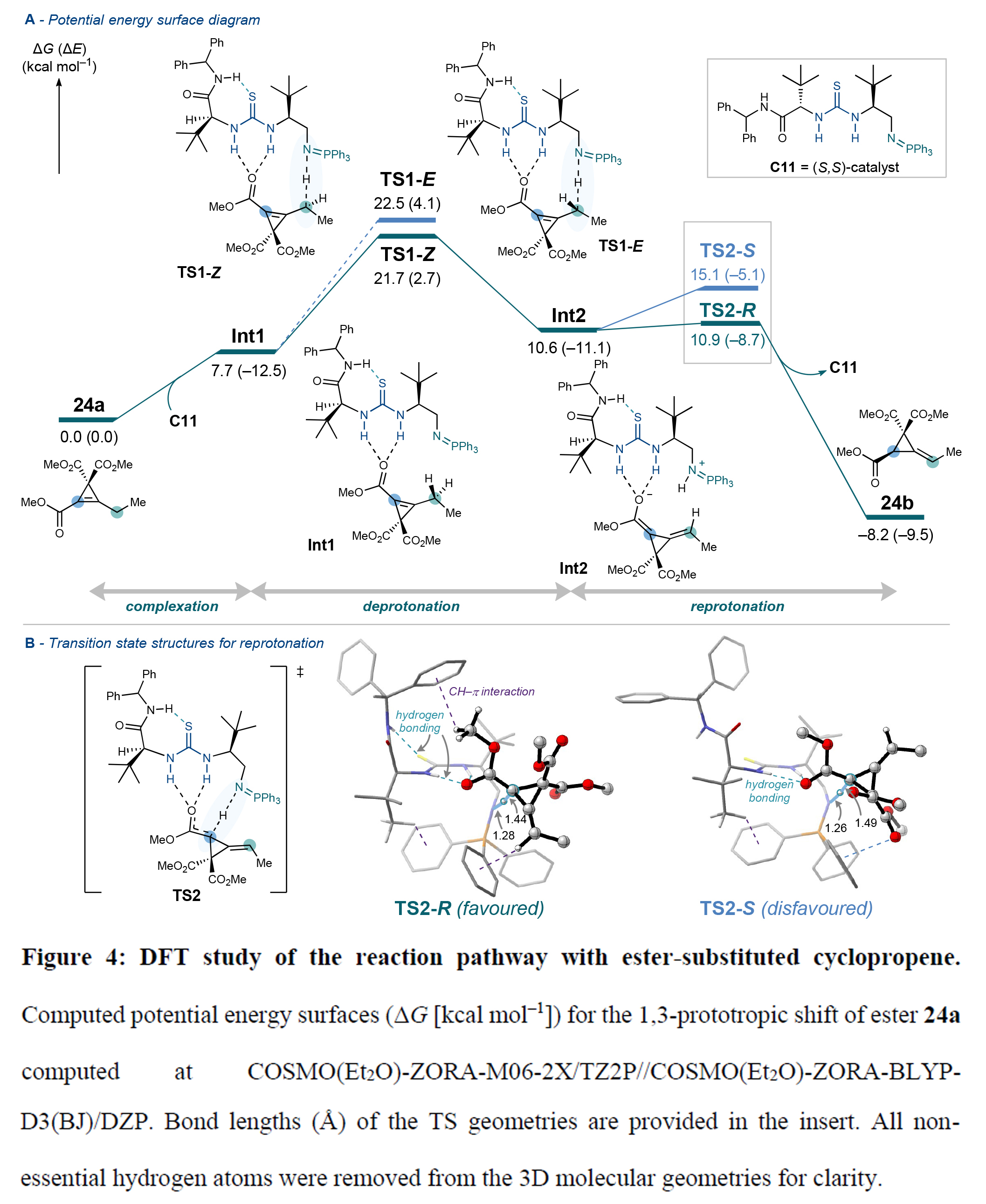
最后,作者通過DFT計算對反應機理進行了考察(Figure4)。作者首先以化合物24a為模板底物研究了環丙烯酯的反應路徑。催化劑C11與24a通過氫鍵形成復合物Int1,經計算比較所有可能的去質子化/再質子化過渡態構型發現,能量最低的TS1-Z過渡態可立體選擇性地生成二烯醇中間體Int2。再經TS2-R或TS2-S質子化,其中最低能過渡態TS2-R生成與實驗絕對構型相符的(R)-產物P-1(ΔΔG?=4.2 kcal mol?1)。TS2-R的幾何優勢源于底物24a與催化劑結合口袋的互補匹配:硫脲S-酰胺H的分子內氫鍵固定了BIMP催化劑"左臂"構象,形成三維限定空間以減小再質子化位阻。能量分解分析揭示該體系存在多種分子間/內穩定相互作用(氫鍵、CH-π等)。
(圖片來源:Nature)
總結
Darren J. Dixon和Trevor A. Hamlin課題組開發了一種新穎高效且適用廣范的ACPs與環丙烷合成方法。兩種BIMP催化劑在酯類、酰胺類、酮類及膦氧化物等多種底物中均展現出優異的反應活性和選擇性。通過底物設計和催化劑堿性亞氨基磷單元的優化,該策略可成功應用于(1R,3R)-順式氯菊酯的全合成,為重要的殺蟲劑骨架提供了全新對映選擇性合成路徑。
文獻詳情:
Catalytic enantioselective synthesis of alkylidenecyclopropanes .
Jonathan C. Golec, Dong-Hang Tan, Ken Yamazaki, Eveline H. Tiekink, Kirsten E. Christensen,Trevor A. Hamlin* and Darren J. Dixon*.
Nature,2025
DOI:10.1038/s41586-025-09485-y
來源: 化學加


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 化學加
化學加 
