近日,Science Bulletin發表了南京大學張辰宇教授團隊題為“RNA immunity: an ancient defense mechanism preserved in mammalian cells”的綜述文章。該文系統提出了“RNA免疫(RNA immunity)”的全新概念,并指出哺乳動物體內保留著一套以小RNA為核心、以堿基互補配對為識別機制的抗病毒系統。這種機制不同于傳統依賴蛋白質的免疫體系,代表了針對病毒類疾病可能存在的“隱匿防線”。
傳統觀點認為,構成人體免疫系統的基本單元是免疫細胞和免疫蛋白。無論是快速響應的天然免疫,還是具有記憶功能的獲得性免疫,均以蛋白質為主要效應分子。RNA曾被視為只在細胞內發揮功能,自2008年后才被發現能夠在細胞外完整、穩定存在,能夠被細胞主動分泌,在組織、器官間傳遞并發揮調控功能。
該綜述通過總結近年來多項針對病毒感染類疾病中細胞外RNA功能的研究,指出以miRNA為代表的RNA分子,可以通過堿基互補配對的方式精準識別病毒基因,其效率和特異性在某些情境下甚至優于傳統的免疫應答。在病毒侵入時,人體內源小RNA、外源植物小RNA及病毒自身編碼小RNA均會在感染過程中發揮不同功能,共同構成了RNA免疫調控網絡(圖1)。研究團隊據此提出**,RNA免疫可能是人體免疫體系中****尚未被認知的一類新型免疫方式**,與以蛋白質分子為主要效應分子的免疫系統互為補充。
文章亮點如下:
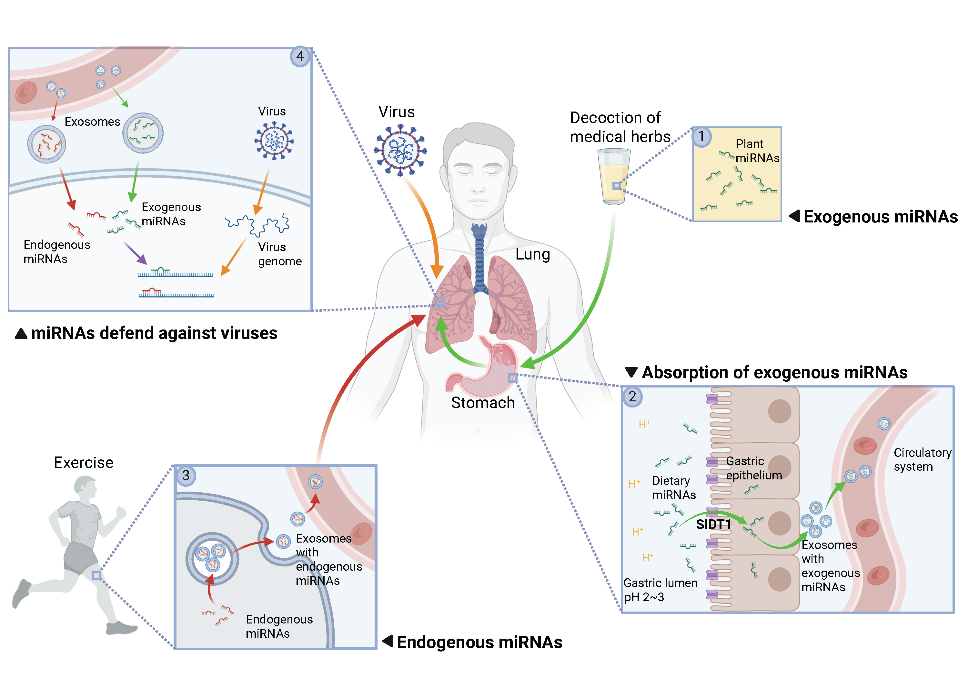
圖1. 不同來源的細胞外RNA在人體內共同構成RNA免疫分子網絡
1 RNA免疫基于序列互補對病毒精準打擊,具備高度特異性與抗突變能力
傳統免疫識別機制主要依賴蛋白質三維結構的“構象互補”,如抗體與抗原的結合。然而這類結構識別在面對病毒頻繁發生的點突變時,常常容易失效。而RNA免疫則采用堿基之間的互補配對實現靶向識別和沉默病毒。這種方式不僅更精確,并且往往能夠在一個病毒基因上發現多個結合位點,即使病毒發生局部突變,也難以完全逃逸。這一機制賦予RNA免疫出色的抗變異能力和多靶點協同效應,在新發病毒和高變異病毒感染中具有重要防御潛力。過去,學界普遍認為這種機制只存在于植物、昆蟲等“低等”生物中,而哺乳動物早已在進化中舍棄了這種系統。但近年來的發現表明,哺乳動物并未完全喪失RNA免疫功能,而是將其以更加隱蔽和動態調控的方式保留并整合至其免疫體系中,這可能是哺乳動物在與病毒共進化過程中發展出的一種“狡猾”的適應方式。
2 不依賴特化免疫系統,構成“去中心化”免疫網絡
如果說天然免疫和獲得性免疫是軍隊中的“特種部隊”,只由特定的免疫細胞執行任務,那么RNA免疫就是一場“全民戰爭”:幾乎所有類型的體細胞均具備合成、釋放功能性小RNA分子的能力。這些小RNA不僅可在細胞內部起作用,還可通過外泌體等方式在細胞間轉移,參與多組織協同應答。這就像比特幣區塊鏈的原理——沒有中央指揮,每個節點都是行動單元,因此更具彈性、更難被病毒完全突破。相比依賴復雜調動機制的蛋白免疫反應,RNA免疫能更早、更快對高傳染性病毒進行早期響應和抑制。
3 RNA免疫效應分子不僅能自身生產,還能靠“進口”
研究發現,由人體自身生產的抗病毒RNA分子在年輕人血液中更充足,但會受到衰老、基礎疾病等不良因素的影響而下降,也能夠隨著運動而提高,這說明RNA免疫能力也會隨著人體狀態的不同而動態變化。更令人驚訝的是,RNA免疫的效應分子并不局限于人體自身產生的分子,某些植物中的小RNA(比如中草藥金銀花中的MIR2911)在被人體攝入后,可以經胃腸吸收進入血液,通過細胞間的外泌體傳輸系統送達全身組織,并直接干擾病毒的復制。這些外源吸收的“RNA彈藥”,能夠有效補充體內的RNA免疫效應分子,增強人體對病毒的作戰能力。研究甚至表明,某些個體的遺傳差異會影響這類植物RNA的吸收效率,提示我們未來可以基于個體差異,開發出精準化的飲食干預手段或新型抗病毒藥物。
該研究所提出的“RNA免疫”概念,為哺乳動物抗病毒防御機制提供了全新的研究方向。RNA免疫通過堿基互補識別實現精確、多位點的干擾,其機制兼具分布廣泛性、反應快速性和來源多樣性,不僅為傳統免疫系統提供有力補充,也可能解釋某些免疫現象中蛋白機制難以覆蓋的空白。通過進一步研究這套RNA免疫系統的工作原理和調控機制,將有望為理解人類與病毒的相互適應關系提供新的視角。該方向的新發現與RNA藥物和小RNA遞送技術的結合,也有望為新型抗病毒藥物設計、RNA疫苗開發、個性化治療等領域提供重要理論依據和實踐路徑。
來源: 《中國科學》雜志社


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 《中國科學》雜志社
《中國科學》雜志社 
