出品:科普中國
作者:李玉歡(吉林大學)
監制:中國科普博覽
在哺乳動物王國里,藏著許多令人費解的進化謎題。當你看到蠑螈能再生斷肢,斑馬魚能修復心臟時,可曾想過,為什么身為哺乳動物的我們,連耳朵上一個微小的傷口都難以完美愈合?這個看似簡單的問題,背后卻隱藏著再生醫學最核心的奧秘。
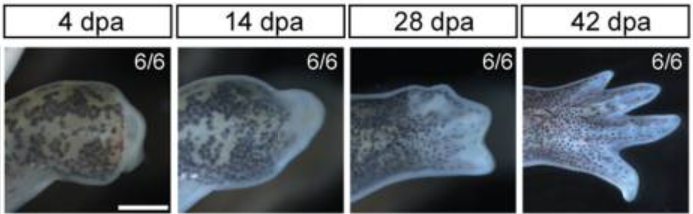
蠑螈截肢后再生代表性圖像
(圖片來源:參考文獻[1])
最近,北京生命科學研究所、清華大學生物醫學交叉研究院研究員王偉實驗室與北京華大生命科學研究院研究員鄧子卿、西北農林科技大學教授羅軍等團隊合作,在《科學》發表研究論文,他們找到了控制哺乳動物再生的“基因開關”,讓本不能再生的小鼠成功長出了全新的耳廓軟骨、皮膚甚至神經。這究竟是如何實現的?
耳朵上的再生之謎
為了解開再生的謎題,科學家盯上了哺乳動物的耳朵——耳廓雖小,但結構復雜,包含皮膚、軟骨、血管,能夠很好地體現再生能力。他們在兔子、山羊等具有再生能力的動物耳廓上打出4毫米孔洞,同時給小鼠、大鼠的耳廓打上2毫米小孔。結果發現,30天內,兔耳傷口竟能完全愈合;而小鼠耳廓的微小孔洞卻一直無法閉合,僅留下了疤痕組織。
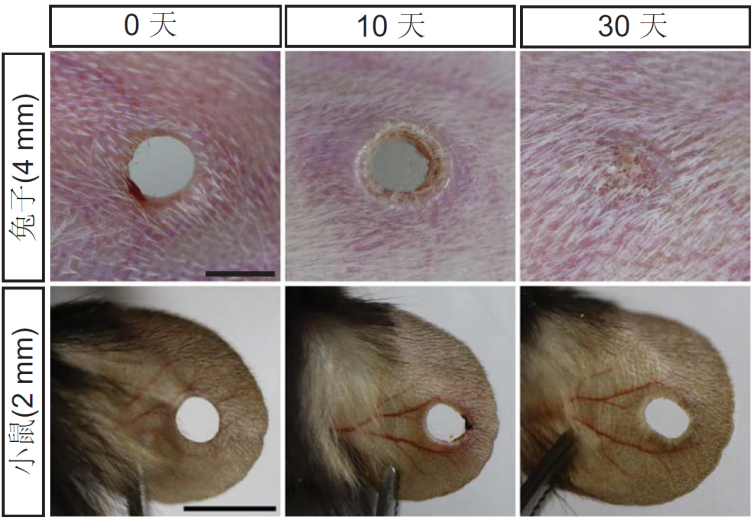
兔子和小鼠的耳廓再生結果
(圖片來源:參考文獻[2])
令人意外的是,當研究人員用單細胞測序技術對兔子和小鼠受傷的耳廓組織進行分析時,竟然發現小鼠其實已經啟動了再生的預備程序,它們和兔子一樣,會在傷口處形成再生芽基,也就是由快速增殖的細胞組成的修復中心。但小鼠的再生程序就像被按下了暫停鍵,無法啟動組織形態發生相關的再生基因。
這個發現推翻了傳統認知:哺乳動物再生能力的缺失,并非因為無法啟動修復,而是因為修復程序被強行中斷了。
揪出關鍵細胞:再生指揮官WIFs
為了找到程序中斷的根源,科學家利用空間轉錄組技術分析了再生的耳廓組織,結果發現在傷口深處潛伏著一群關鍵細胞——傷口誘導成纖維細胞(WIFs)。它們如同再生工程的指揮官,在兔子體內高效調度修復工作:指揮干細胞分化軟骨,引導血管新生,組織神經重建。
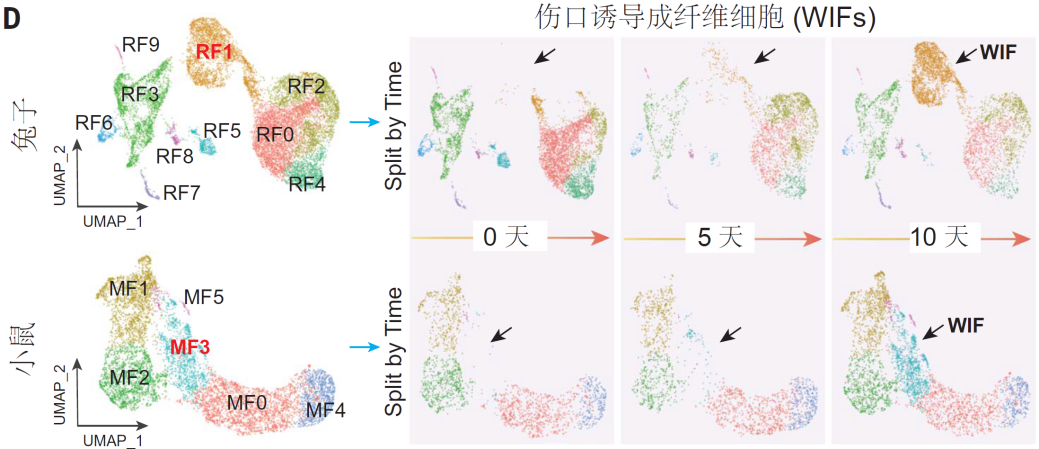
兔子和小鼠損傷耳廓組織中的WIFs
(圖片來源:參考文獻[2])
但這群指揮官在小鼠體內卻消極怠工了。通過對比數萬個細胞基因表達譜,科學家發現,兔子的WIFs會激活469個再生相關基因,其中包括控制骨骼形態的Bmp2、調控組織重建的Lef1等核心基因。而小鼠的WIFs卻被疤痕基因主宰,特別是肌成纖維細胞標記物Acta2異常活躍,將傷口引向纖維化而非再生。
更關鍵的是,小鼠的WIFs不僅自身消極怠工,其周圍微環境也十分惡劣。在兔子中,WIFs能接收表皮細胞發出的再生信號和肌肉細胞的形態發生指令,而小鼠的WIFs卻被中性粒細胞釋放的炎癥因子所包圍。
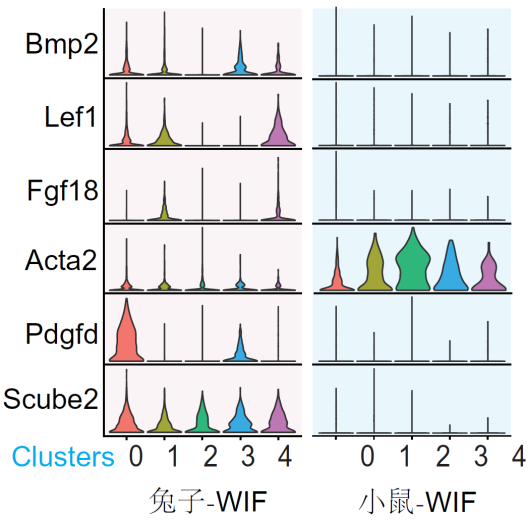
兔子和小鼠的WIFs中激活的基因
(圖片來源:參考文獻[2])
破解基因開關:Aldh1a2的進化封印
究竟是什么讓WIFs罷工了?通過基因表達譜比較,研究團隊發現了一個關鍵差異:Aldh1a2基因的表達。Aldh1a2編碼的酶負責生產維甲酸(RA),這是一種已知在發育和再生過程中起重要作用的信號分子。
在兔子中,Aldh1a2在受傷后被強烈激活,源源不斷地產生RA,這些RA分子精準定位到WIFs,激活再生程序;而在小鼠中,Aldh1a2的表達幾乎檢測不到。更糟的是,小鼠體內的RA降解途徑在受傷后反而增強,導致本就匱乏的RA水平雪上加霜。
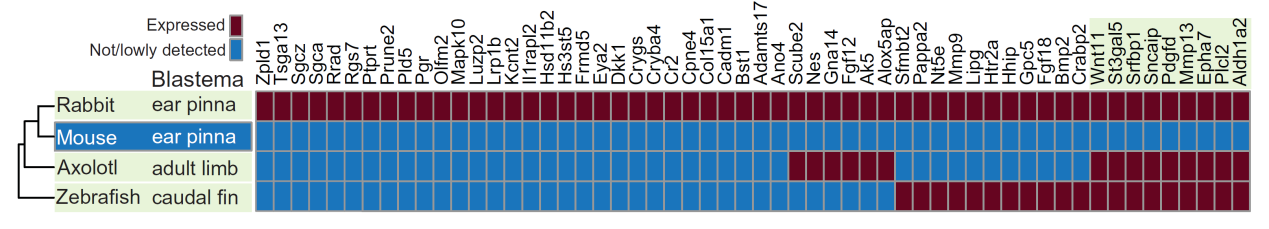
高再生潛能動物芽基中常見激活基因的鑒定,其中紅色表示激活的基因,藍色表示未激活的基因,小鼠耳廓為第二排。
(圖片來源:參考文獻[2])
為什么小鼠的Aldh1a2基因在受傷后無法正常激活呢?研究人員在比較了兔子和小鼠基因組后發現,兔子的Aldh1a2基因周圍有6個增強子元件(AE1~AE6),其中有兩個增強子(AE1和AE5)在耳廓受傷再生時會被強烈激活,與基因啟動子相互作用,激活基因表達。而在小鼠中,Aldh1a2基因的6個增強子元件有5個徹底失活。這可能是因為在嚙齒動物祖先的演化過程中,為了適應環境壓力,拋棄了這個“再生開關”。
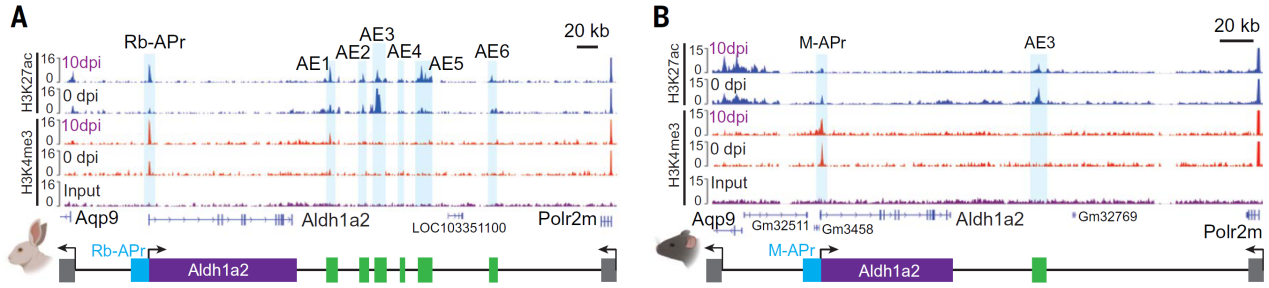
兔子和小鼠Aldh1a2基因的活性增強子和啟動子
(圖片來源:參考文獻[2])
兩種鑰匙:重新打開“再生開關”
面對這個失效的“再生開關”,研究團隊設計了兩種破解方案:第一種是基因置換。通過改造的腺相關病毒載體(AAV),將兔子的Aldh1a2基因直接遞送到小鼠耳部傷口。結果發現,原本不愈合的耳洞開始收縮,新生軟骨在30天內形成完整環狀結構,甚至重新長出了被切斷的神經纖維。
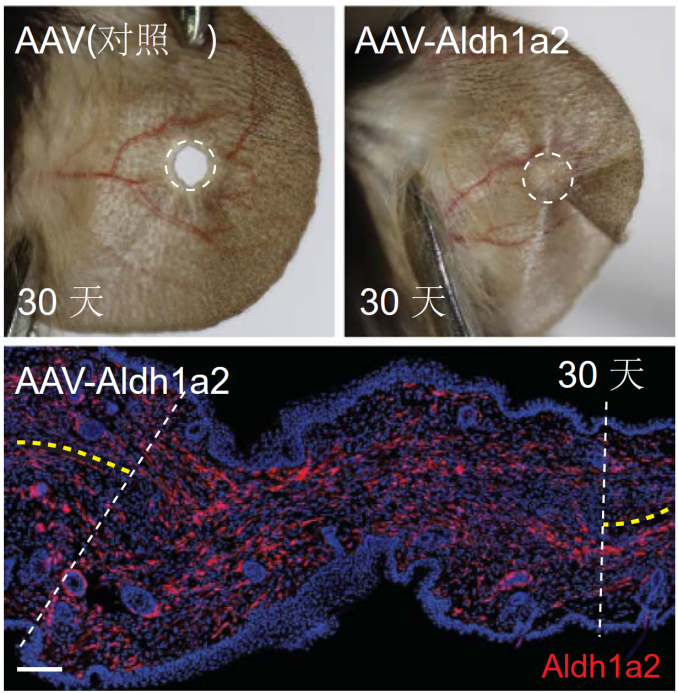
上圖顯示過表達Aldh1a2的小鼠完全恢復了耳廓再生,下圖為過表達的Aldh1a2的免疫熒光染色(紅色)
(圖片來源:參考文獻[2])
第二種是外源補充RA。結果顯示,腹腔注射RA的小鼠耳廓在30天內完全再生,效果與基因治療組相當。更有趣的是,當RA與其降解抑制劑TLZ聯用時,再生速度進一步加快,證明了RA的代謝平衡對再生修復至關重要。
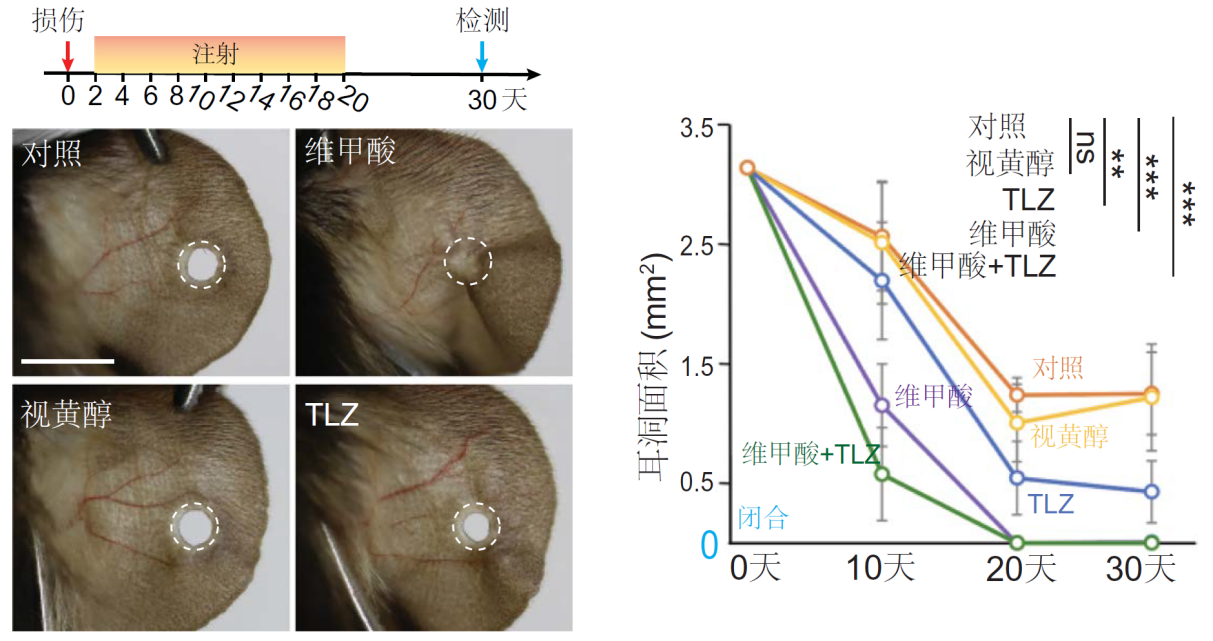
腹腔注射RA可完全恢復小鼠耳廓再生
(圖片來源:參考文獻[2])
人類能獲得再生超能力嗎?
這項研究不僅解釋了為什么小鼠不能再生耳朵,更揭示了哺乳動物再生能力的進化調控共性。當團隊分析其他可再生動物時,發現RA信號通路始終扮演關鍵角色:在斑馬魚鰭再生中調控骨骼模式(參考文獻[3]),在蠑螈肢體再生中指導細胞分化(參考文獻[4]),甚至在鹿角再生中協調季節性生長(參考文獻[5])。而這項研究發現了RA與再生核心開關AP-1復合物的互動,更暗示了跨物種的保守調控機制。
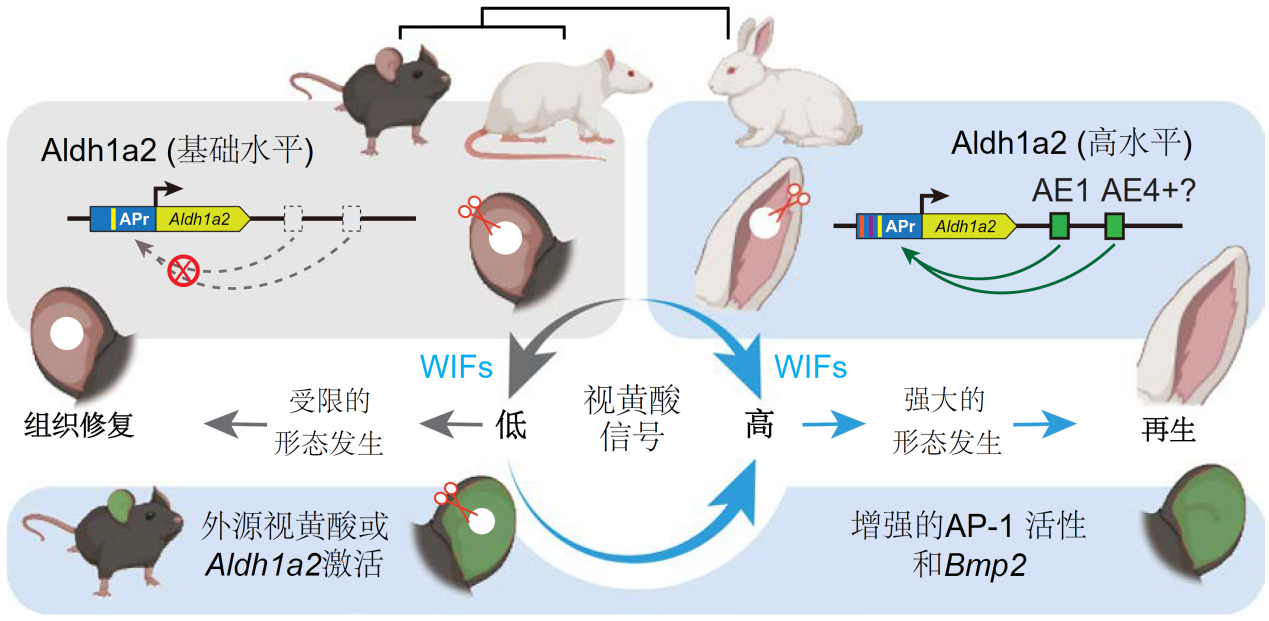
小鼠在進化過程中耳廓再生失敗的機制模型
(圖片來源:參考文獻[1])
對人類醫學而言,希望與挑戰并存:目前RA藥物已用于白血病治療,安全性得到了驗證。理論上,通過緩釋材料將RA遞送至關節軟骨損傷處,或可激活人成纖維細胞的再生潛能。但挑戰同樣巨大,人類器官比小鼠耳廓復雜多得多,而且長期的RA治療可能會引發維甲酸綜合征、肝損傷等副作用。
結語
從蜥蜴的尾巴到小鼠的耳朵,自然界隱藏的再生密碼正被逐一破譯。這項研究的價值遠超耳廓再生本身,它首次在哺乳動物中證明,再生能力的丟失并非不可逆的進化代價,而只是調控再生的關鍵“基因開關”被關閉了。
或許不久的將來,皮膚創傷、關節軟骨損傷甚至器官修復都將迎來全新的再生療法。這一次,我們站在了解鎖人類潛在再生能力的起點上。
參考文獻:
[1] Zhulyn, Olena, et al. Evolutionarily divergent mTOR remodels translatome for tissue regeneration. Nature 620.7972 (2023): 163-171.
[2] Lin, W., et al., Reactivation of mammalian regeneration by turning on an evolutionarily disabled genetic switch. Science, 2025. 388(6754): p. eadp0176.
[3]White, J.A., et al., A zebrafish retinoic acid receptor expressed in the regenerating caudal fin. Development, 1994. 120(7): p. 1861-72.
[4] Duerr, T.J., et al., Retinoic acid breakdown is required for proximodistal positional identity during axolotl limb regeneration. Nat Commun, 2025. 16(1): p. 4798.
[5] Allen, S.P., M. Maden, and J.S. Price, A role for retinoic acid in regulating the regeneration of deer antlers. Dev Biol, 2002. 251(2): p. 409-23.

來源: 中國科普博覽
內容資源由項目單位提供


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 中國科普博覽
中國科普博覽 
