導(dǎo)讀
近日,美國俄亥俄州立大學(xué)(The Ohio State University)David A. Nagib課題組報道了一種利用鐵催化劑和鋅還原劑,從相對穩(wěn)定的二氯化物出發(fā)生成含多種取代基卡賓的新方法。由于采用統(tǒng)一的制備途徑,作者還系統(tǒng)性地分類研究了不同取代基對卡賓反應(yīng)活性的影響。文章鏈接DOI:10.1126/science.adw4177。
(圖片來源:Science)
正文
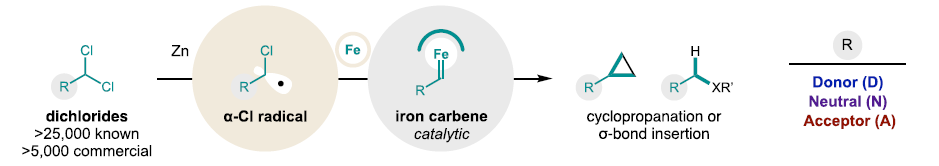
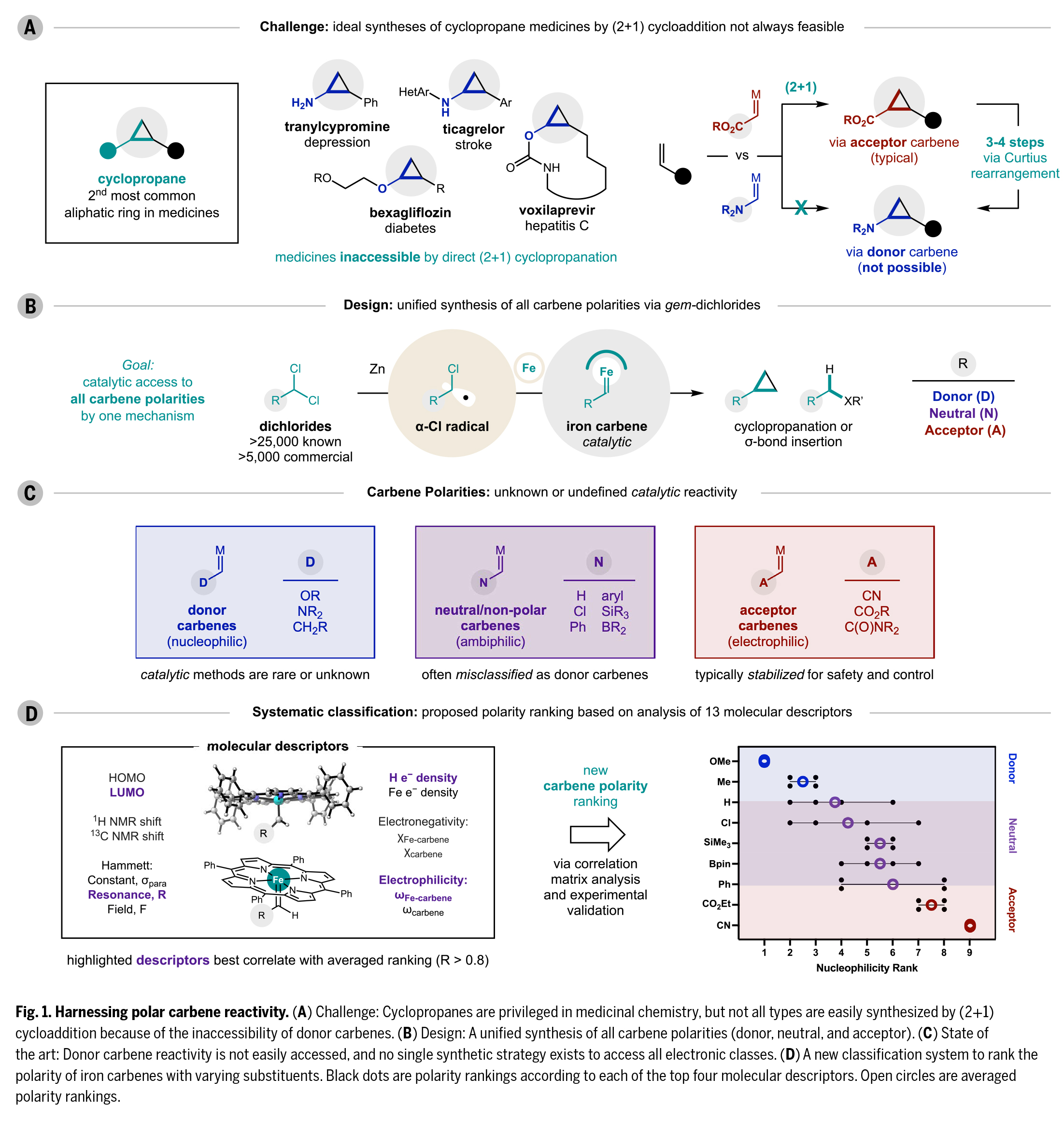
金屬卡賓作為有機(jī)合成中極具價值的高活性中間體,其催化合成仍面臨兩大挑戰(zhàn):1)并非所有極性類型的卡賓都能通過催化途徑獲得;2)缺乏能制備全系列電子特性卡賓的通用前體。最近,美國俄亥俄州立大學(xué)David A. Nagib課題組突破性地開發(fā)了鐵催化的反應(yīng)策略,其可合成包含供電子(OMe、NR2、烷基)、吸電子(CN、CO2R)及電中性(H、BR2、SiR3、鹵素、芳基/雜芳基)取代的卡賓。該策略通過α-氯自由基途徑,實(shí)現(xiàn)了(2+1)環(huán)丙烷化和σ鍵插入反應(yīng)的廣譜卡賓偶聯(lián)。這一溫和、高效且電子特性可調(diào)的合成方法,不僅建立了基于動力學(xué)和熱力學(xué)參數(shù)的金屬卡賓分類新標(biāo)準(zhǔn),還衍生出類似于點(diǎn)擊化學(xué)的卡賓反應(yīng)及其水相適配的反應(yīng)體系,為化學(xué)生物學(xué)應(yīng)用提供了新工具(Fig. 1)。歡迎下載化學(xué)加APP到手機(jī)桌面,合成化學(xué)產(chǎn)業(yè)資源聚合服務(wù)平臺。
(圖片來源:Science)
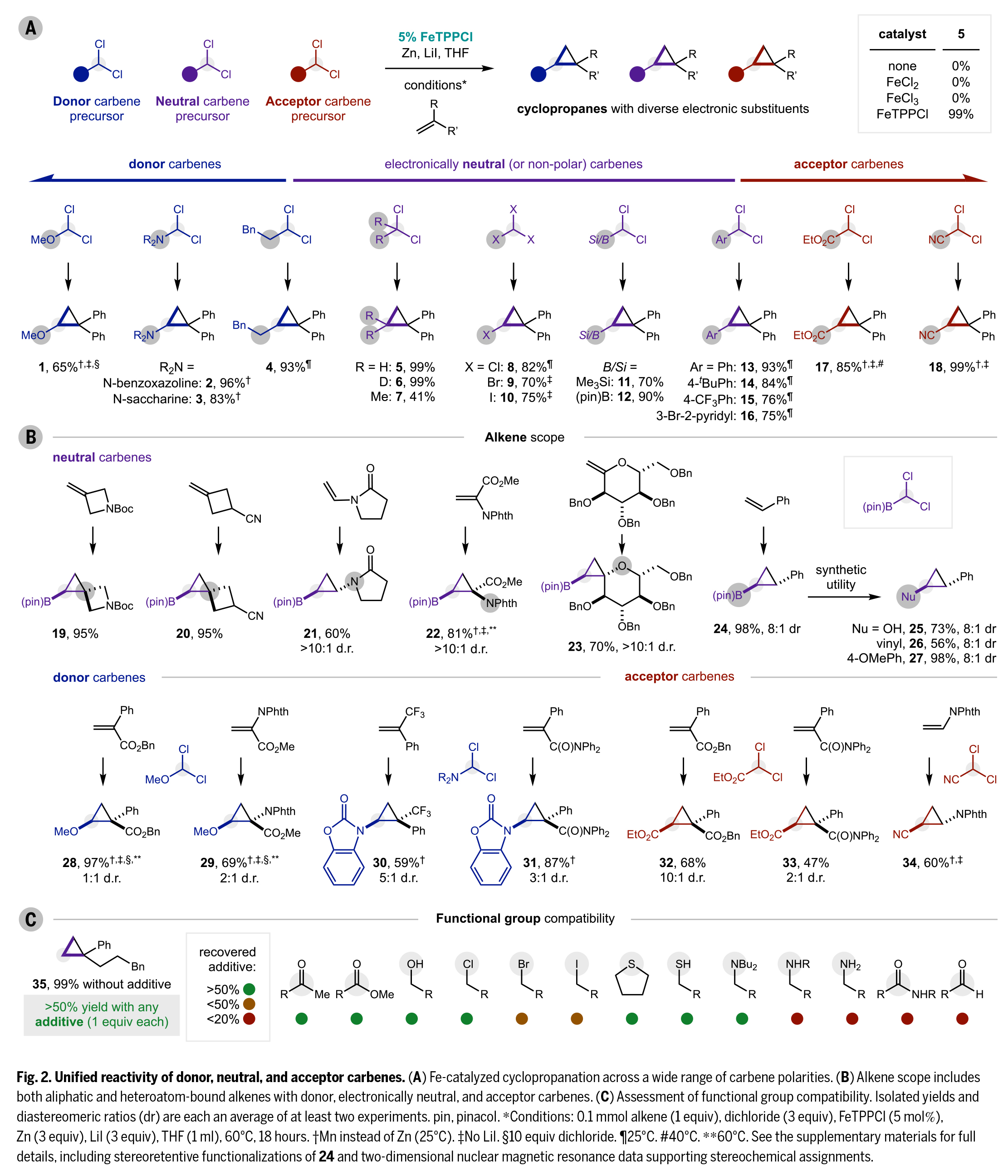
首先,作者成功開發(fā)了一種基于商業(yè)可得的偕二氯化合物與烯烴的(2+1)環(huán)丙烷化反應(yīng)(FeTPPCl為預(yù)催化劑,Zn為還原劑,LiI為自由基介導(dǎo)物)(Fig. 2A)。該策略適用于多種極性卡賓,包括供電子卡賓(R = OMe或NR2,1-3,65-96%)、烷基卡賓(4,93%)、CH2Cl2/CD2Cl2前體產(chǎn)生的卡賓(R = H/D,5-6,99%)以及偕二烷基卡賓(7,41%)。特別值得注意的是,中性鐵卡賓可通過鹵仿(8-10,70-82%)、硅基/硼基二氯化合物(11-12,70-90%)等前體制備,且所得的連有鹵素、硼酸酯等官能團(tuán)的環(huán)丙烷產(chǎn)物可進(jìn)一步官能團(tuán)化。此外,芳基卡賓(13-16,75-93%)和連有吸電子基團(tuán)修飾的卡賓(酯基17,85%、氰基18,99%)也表現(xiàn)優(yōu)異。
此外,該反應(yīng)對烯烴底物同樣展現(xiàn)出廣譜適用性(Fig. 2B)。其中,1,1-二取代脂肪族烯烴與苯乙烯類似物可高效反應(yīng),環(huán)外烯烴可構(gòu)建含氮雜環(huán)丁烷、環(huán)丁烷等藥用常見結(jié)構(gòu)的螺環(huán)產(chǎn)物(19-20,95%)。烯酰胺(21,60%)、乙烯基鄰苯二甲酰亞胺(22,81%)和烯醇醚(23,70%)等雜原子烯烴也可順利轉(zhuǎn)化,立體選擇性優(yōu)異(dr > 10:1)。以硼酸酯修飾的環(huán)丙烷24為例,其可通過氧化、格氏加成、交叉偶聯(lián)等反應(yīng)衍生為醇25(73%)、烯烴26(56%)和芳烴27(98%),且完全保持立體構(gòu)型。
值得注意的是,該反應(yīng)在酮、酯、醇、硫醚等添加劑存在下仍能保持> 50%的產(chǎn)率(35),展現(xiàn)出優(yōu)異的官能團(tuán)兼容性(Fig. 2C)。三級胺可完全兼容,而伯/仲胺、酰胺和醛類則會發(fā)生副反應(yīng)。這一模塊化策略為復(fù)雜分子中環(huán)丙烷結(jié)構(gòu)的構(gòu)建提供了高效途徑。
(圖片來源:Science)
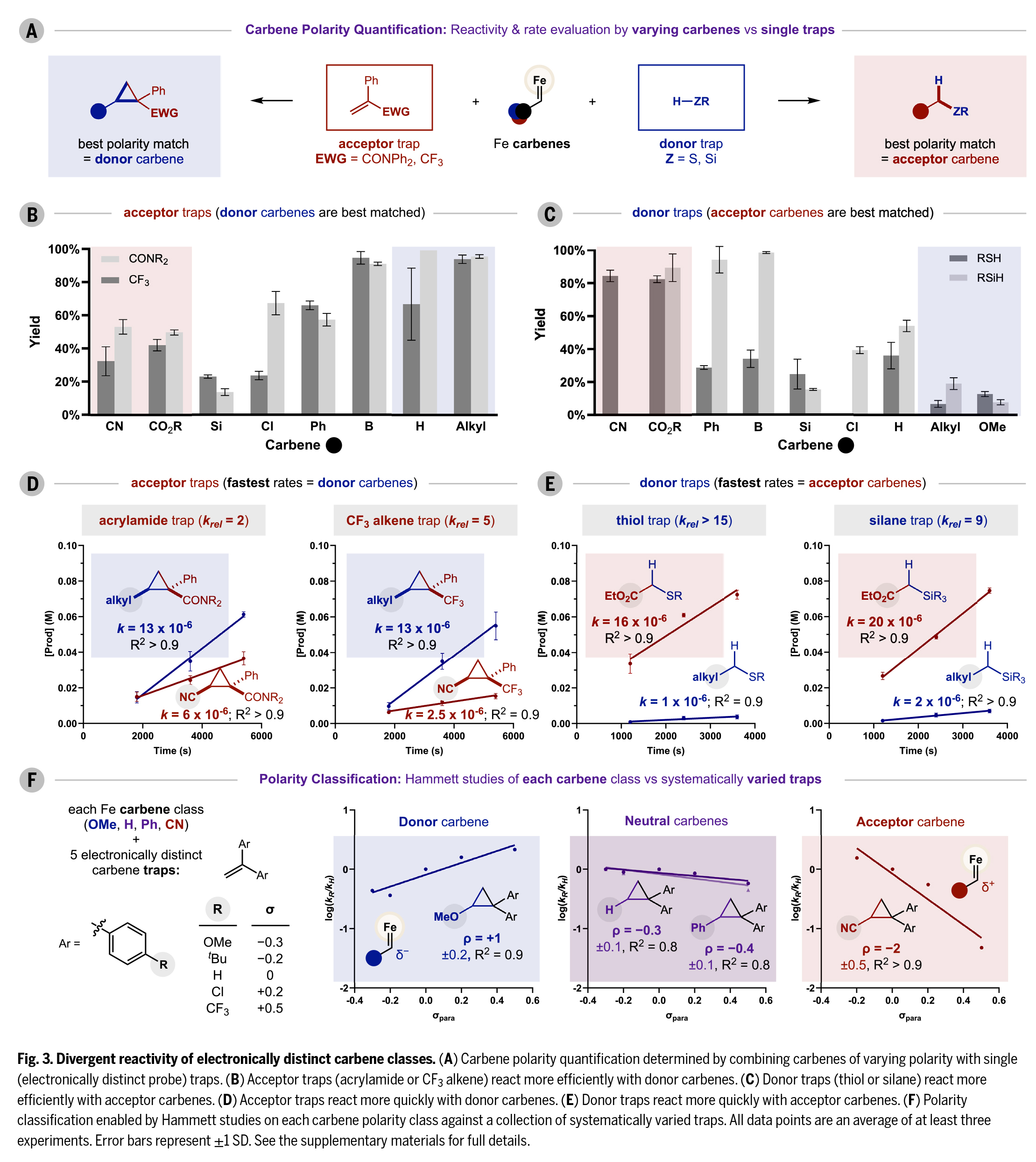
接下來,作者通過三種策略系統(tǒng)研究了卡賓極性對反應(yīng)活性的影響機(jī)制(Fig. 3)。首先,針對九類代表性R基團(tuán),分別選用兩種缺電子受體捕獲劑(丙烯酰胺和三氟甲基烯烴,F(xiàn)ig. 3A紅色)和兩種富電子供體捕獲劑(硫醇和硅烷,F(xiàn)ig. 3A藍(lán)色)進(jìn)行平行實(shí)驗(yàn)。標(biāo)準(zhǔn)條件下16小時的實(shí)驗(yàn)數(shù)據(jù)顯示(Fig. 3B):供體卡賓與受體捕獲劑反應(yīng)活性最高(產(chǎn)率顯著高于中性/受體卡賓),而受體卡賓則與供體捕獲劑反應(yīng)更優(yōu)(Fig. 3C),中性卡賓介于兩者之間。動力學(xué)研究表明(Fig. 3D-E),供體(烷基)卡賓與受體捕獲劑的反應(yīng)初速度是受體(氰基)卡賓的5倍;而受體(酯基)卡賓與供體捕獲劑的反應(yīng)速度則比供體卡賓快10倍以上,這解釋了受體卡賓在σ鍵插入反應(yīng)中的優(yōu)勢。
作者進(jìn)一步通過四組Hammett研究定量表征卡賓極性(Fig. 3F):以對位取代苯乙烯為底物,測得供體(OMe)、中性(H)和受體(CN)卡賓的反應(yīng)常數(shù)ρ分別為+1±0.2、-0.3±0.1和-2±0.5,準(zhǔn)確反映了其電子特性。值得注意的是,芳基卡賓(Ph)實(shí)際表現(xiàn)為中性電性(ρ = -0.4±0.1),比CH2卡賓更具親電性,這與以往"供體卡賓"的認(rèn)知不同。
(圖片來源:Science)
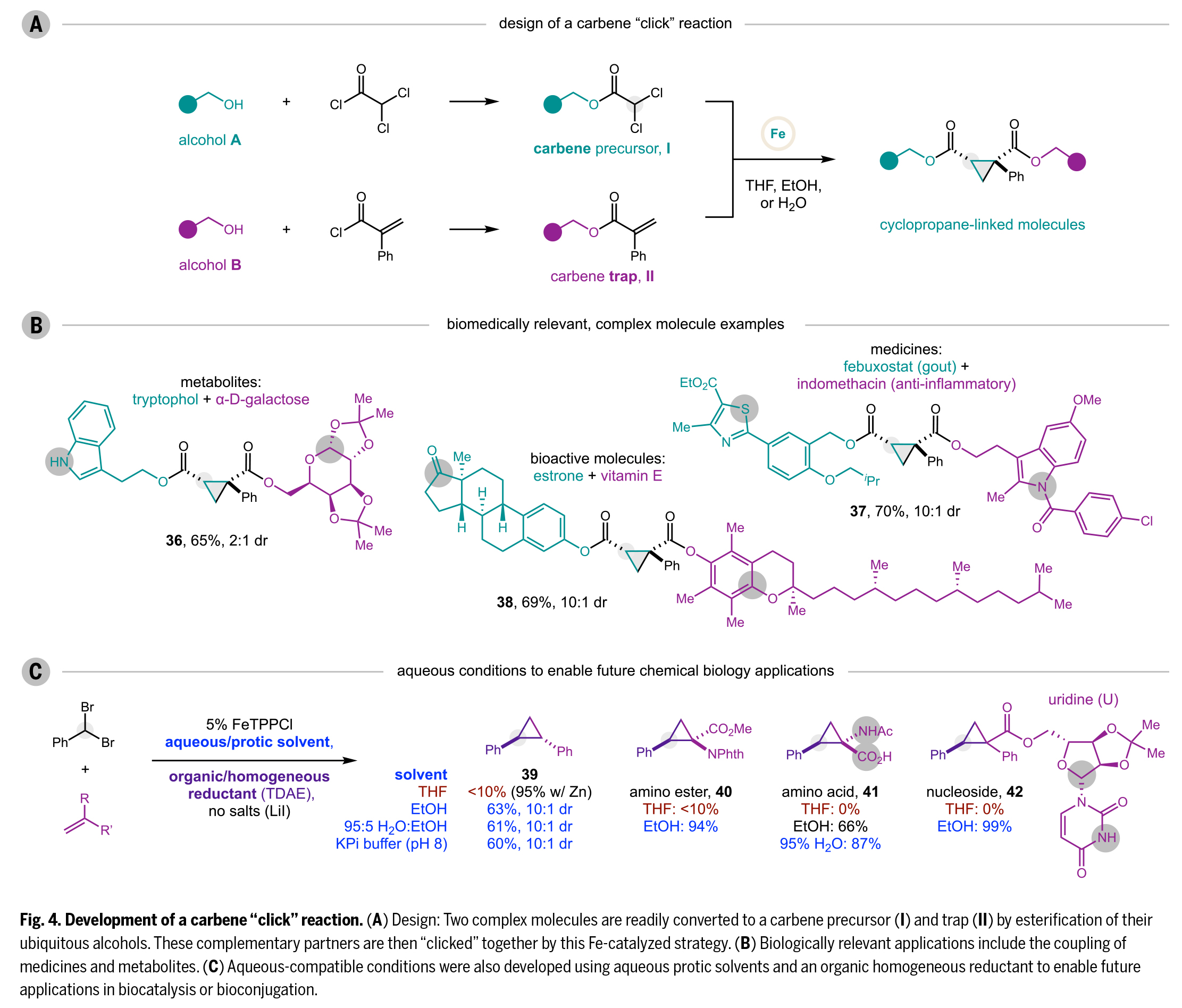
基于該方法的簡便性,作者開發(fā)了一種類點(diǎn)擊化學(xué)的卡賓偶聯(lián)反應(yīng)(Fig. 4A),其高效性、選擇性和實(shí)用性可媲美(3+2)Huisgen環(huán)加成反應(yīng)。與炔-疊氮環(huán)加成產(chǎn)生的三唑環(huán)相比,(2+1)環(huán)丙烷化能構(gòu)建更小、更強(qiáng)且具有獨(dú)特空間取向的全碳環(huán),這些特性使其在藥物設(shè)計中備受青睞。該策略的創(chuàng)新之處在于:通過簡單的酰化將生物分子中的羥基轉(zhuǎn)化為互補(bǔ)反應(yīng)模塊。醇A經(jīng)α,α-二氯酰氯修飾形成卡賓前體I,醇B經(jīng)α-苯基丙烯酰氯修飾形成卡賓捕獲劑II。如Fig. 4B所示,該方法成功實(shí)現(xiàn)了多種生物分子的高效偶聯(lián),包括代謝物(色氨醇與α-D-半乳糖,36,65%)、藥物(非布索坦與吲哚美辛,37,70%)和生物活性分子(雌酮與維生素E,38,69%)。其中灰色圓圈標(biāo)示了傳統(tǒng)生物偶聯(lián)技術(shù)難以兼容的官能團(tuán),為重氮環(huán)丙烷方法提供了新的選擇。
針對水相體系的應(yīng)用需求(如生物催化、生物偶聯(lián)或DNA編碼庫合成),作者進(jìn)一步優(yōu)化了反應(yīng)條件(Fig. 4C):(1)以有機(jī)還原劑TDAE(四(二甲氨基)乙烯)替代無機(jī)還原劑(Zn/Mn);(2)去除LiI鹽;(3)采用活性更高的偕二溴化物。該體系在乙醇中的反應(yīng)效率優(yōu)于THF,且適用于含5%乙醇的緩沖水溶液(95:5 H2O:EtOH,KPi緩沖液pH 8)。除苯基卡賓與苯乙烯的模板反應(yīng)(39)外,氨基酯40(94%)、氨基酸41(87%)和核苷42(99%)等質(zhì)子性生物分子在質(zhì)子溶劑中也表現(xiàn)出更佳的環(huán)丙烷化效率,這可能歸因于其溶解度的改善。
(圖片來源:Science)
總結(jié)
David A. Nagib課題組開發(fā)了一種基于商業(yè)可得試劑的通用催化策略,可通過統(tǒng)一機(jī)制調(diào)控各類卡賓極性。首次實(shí)現(xiàn)了全極性卡賓的催化統(tǒng)一合成,解決了供體卡賓難以直接生成的難題。通過實(shí)驗(yàn)與計算結(jié)合,建立了卡賓極性的定量分類標(biāo)準(zhǔn)。為藥物設(shè)計(尤其是含環(huán)丙烷結(jié)構(gòu))提供了高效工具,將推動生物偶聯(lián)與材料化學(xué)發(fā)展。
文獻(xiàn)詳情:
Harnessing carbene polarity: Unified catalytic access to donor, neutral, and acceptor carbenes.
Khue N. M. Nguyen, Xueling Mo, Bethany M. DeMuynck,Mohamed Elsayed, Jacob J. A. Garwood, Duong T. Ngo,Ilias Khan Rana, David A. Nagib*.
Science,2025, 389, 183-189.
DOI:10.1126/science.adw4177
來源: 化學(xué)加


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 化學(xué)加
化學(xué)加 
