中藥抗癌新突破!廣中醫團隊首次發現金蓉顆粒的抗癌密碼,登上國際頂刊!
在現代社會,癌癥已經成為威脅人類健康的重大疾病之一,轉移復發是導致腫瘤臨床治療失敗及多少癌癥死亡的主要原因,它極大地降低了患者的生存率和生活質量。據統計,90%以上的乳腺癌患者死亡是由腫瘤轉移造成的,轉移部位多見肺、骨、腦。同時約6%的患者最初被診斷為轉移性乳腺癌,20%-50%的原發性乳腺癌在首次確診后3-10年或更長時間會發生遠處轉移,部分患者腫瘤發生早期在血液和骨髓中即可檢測到循環癌細胞的存在。
在抗癌的研究道路上,傳統中藥常常能給科學家們帶來意想不到的啟示。廣州中醫藥大學研究團隊從創新中藥金蓉顆粒中揪出關鍵抗癌密碼——寶藿苷I(BHS),首次揭示其通過改造腫瘤微環境,抑制乳腺癌轉移的全新機制。這項名為“Baohuoside i suppresses breast cancer metastasis by downregulating the tumor-associated macrophages/C-X-C motif chemokine ligand 1 pathway”的研究登上國際權威期刊《Phytomedicine》,該研究為乳腺癌治療提供了新型候選藥物,不僅為乳腺癌患者帶來新希望,更讓世界看到中醫藥現代化的典范。

圖1 論文首頁
以往研究表明,金蓉顆粒可以通過調節腫瘤相關巨噬細胞(TAMs)/C-X-C基序趨化因子配體1(CXCL1)途徑,顯著抑制乳腺癌轉移。TAMs和CXCL1在乳腺癌轉移過程中扮演著重要的角色。TAMs原本是身體免疫系統的一部分,但在腫瘤微環境中幫助癌細胞生長、轉移。而CXCL1能夠吸引癌細胞向周圍組織和遠處器官轉移。然而,金蓉顆粒是由多種中藥成分組成的復雜混合物,其中究竟是哪種成分在發揮抗轉移的作用仍不清楚。
一、活性成分精準鎖定
研究通過生物活性導向分離技術,經過大量的實驗和篩選,終于發現了一種關鍵的生物活性成分——寶藿苷I(BHS)。質譜與核磁共振分析顯示,寶藿苷I能顯著降低TAMs中CXCL1的轉錄與分泌(p < 0.05),且無顯著細胞毒性(IC50 > 10 μM)。而且結果顯示寶藿苷I在低濃度(2×10 μm)同樣能顯著抑制乳腺癌細胞系BT549和4T1的集落形成能力,表明金蓉顆粒可以在長期給藥后抑制乳腺癌細胞的增殖(圖2B)
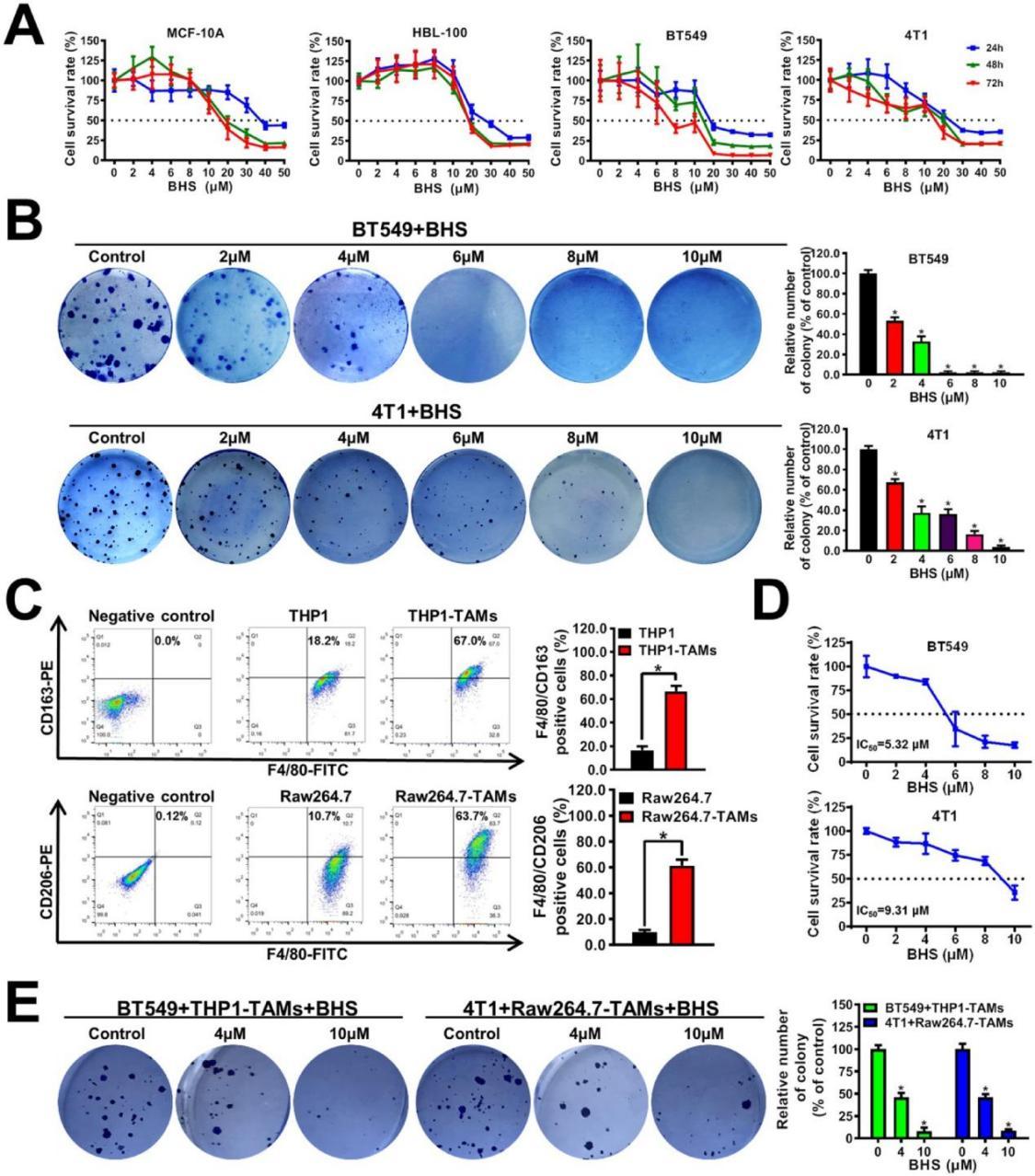
圖2 BHS顯著抑制共培養系統中乳腺癌細胞的生長。
二、多重抗轉移機制
以往研究發現腫瘤微環境中的腫瘤相關巨噬細胞(TAMs)就像癌細胞的"保鏢",它們分泌的CXCL1趨化因子會:
? 開綠燈:激活癌細胞遷移、侵襲能力,促進癌細胞擴散;
? 養精兵:增加癌癥干細胞比例,增強癌細胞干細胞特性(導致復發耐藥);
? 建屏障:形成免疫抑制微環境(讓化療失效)。
而金蓉顆粒中的寶藿苷I能夠“多管齊下”,具有多種策略:
1、正面直接作用:抑制乳腺癌細胞遷移、侵襲及干細胞特性
研究發現BHS可以顯著抑制BT549和4T1細胞的遷移和侵襲能力。同時,BHS還顯著消除了TAMs-CM 對乳腺癌細胞遷移和侵襲的促進作用(圖 4A-B)。BHS顯著降低了BT549細胞和 4T1細胞中的ALDH+亞群的數量,而TAMs-CM顯著增加了這些群體的數量,表明 BHS可以抑制乳腺CSCs的自我更新,而TAMs-CM(培養基)可以促進乳腺CSCs的自我更新。同時,BHS還顯著消除了TAMs-CM對乳腺CSCs自我更新的促進作用(圖4C)。此外,BHS顯著減弱了BT549和4T1細胞中包括波形蛋白(Vimentin)和MMP2在內的轉移相關蛋白的表達水平,而TAMs-CM達到了相反的效果,表明 BHS可以抑制乳腺癌轉移,而TAMs-CM可以促進乳腺癌轉移。此外,BHS顯著逆轉了TAMs-CM對乳腺癌細胞中轉移相關蛋白的上調作用(圖 4D)。總之,即使在 TAMs存在的情況下,BHS也可以在體外抑制乳腺癌轉移。
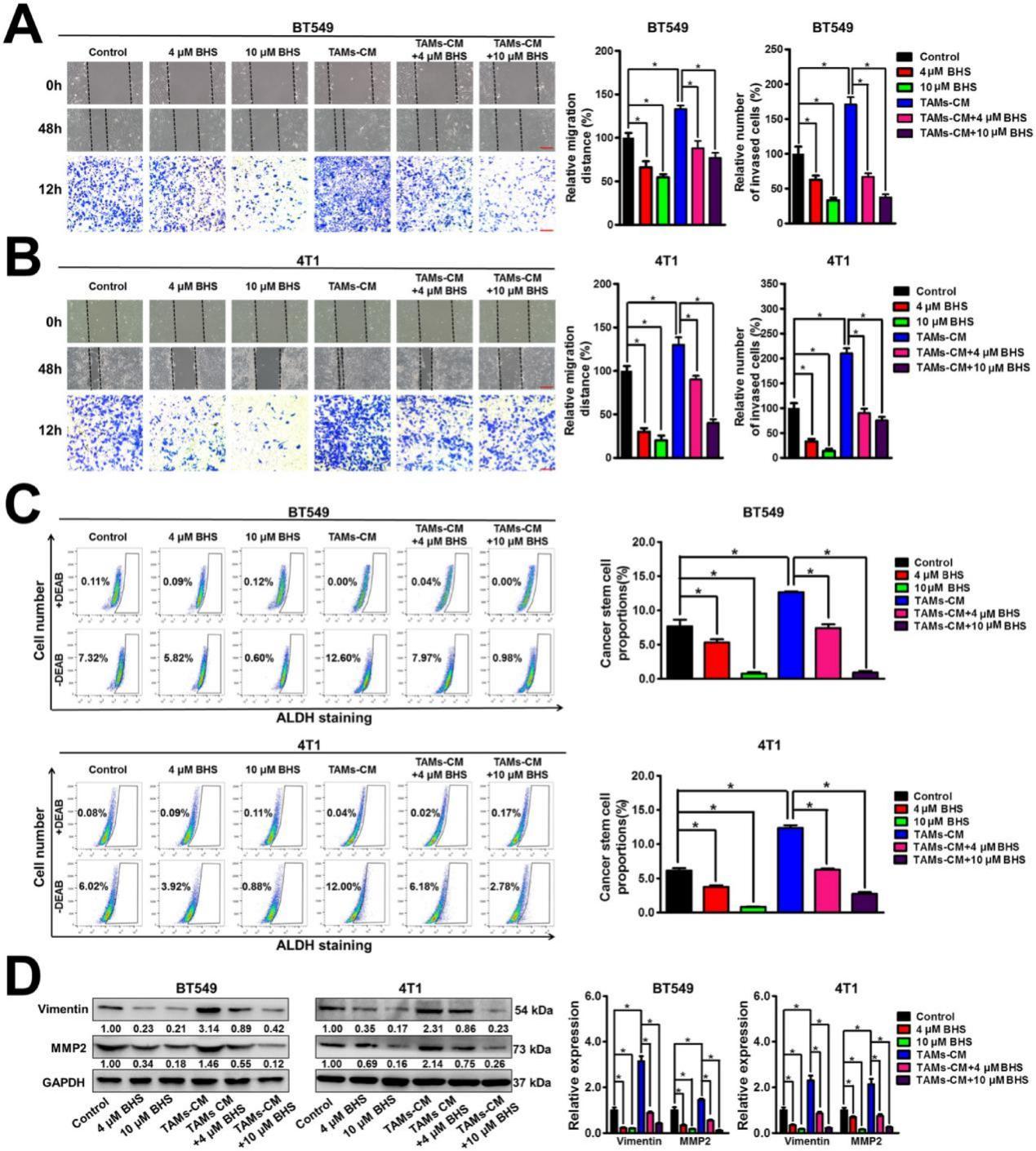
圖3.BHS顯著抑制TAMs誘導的乳腺癌細胞轉移。
2、阻斷后援并策反敵軍:在抑制TAMs的M2表型極化,同時將促癌的M2型巨噬細胞逆轉為抗腫瘤的M1型。
TAMs有兩種不同的表型,即M1表型和M2表型。M1表型的TAMs能夠攻擊和消滅癌細胞;而M2表型的TAMs會促進癌細胞的生長和轉移。低濃度的BHS能顯著消除TAMs-CM對乳腺癌細胞增殖和轉移的促進作用。進一步實驗表明,BHS可以劑量依賴性地逆轉TAMs的M2表型極化(圖3B)。這意味著BHS能夠改變TAMs的狀態,使其朝著不利于腫瘤生長和轉移的方向發展。同時寶藿苷I能夠抑制TAMs向M2表型極化,為抑制乳腺癌的進展提供了一種潛在的干預途徑。
3、關閉癌細胞“指揮部”,切斷軍令信號:抑制TAMs分泌,減弱CXCL1的表達和分泌,使癌細胞失去轉移指令。
TAMs的分泌功能在乳腺癌的發生、發展中起著關鍵作用。酶聯免疫吸附試驗分析表明,BHS還以劑量依賴性方式顯著抑制TAMs分泌CXCL1(圖3C)。除了抑制CXCL1的分泌,BHS還可能對TAMs分泌的其他促腫瘤因子產生影響。通過調節TAMs的分泌,BHS可以整體改善腫瘤微環境,抑制乳腺癌細胞的轉移。
CXCL1是癌細胞轉移的信號,它的異常表達和分泌會促進乳腺癌細胞的增殖和轉移。寶藿苷I能夠以劑量依賴性方式顯著抑制TAMs中CXCL1的表達和分泌。同時,BHS還抑制了CXCL1基因的啟動子活性,從源頭減少了CXCL1的產生(圖3D-F),為乳腺癌治療提供了新的靶點。
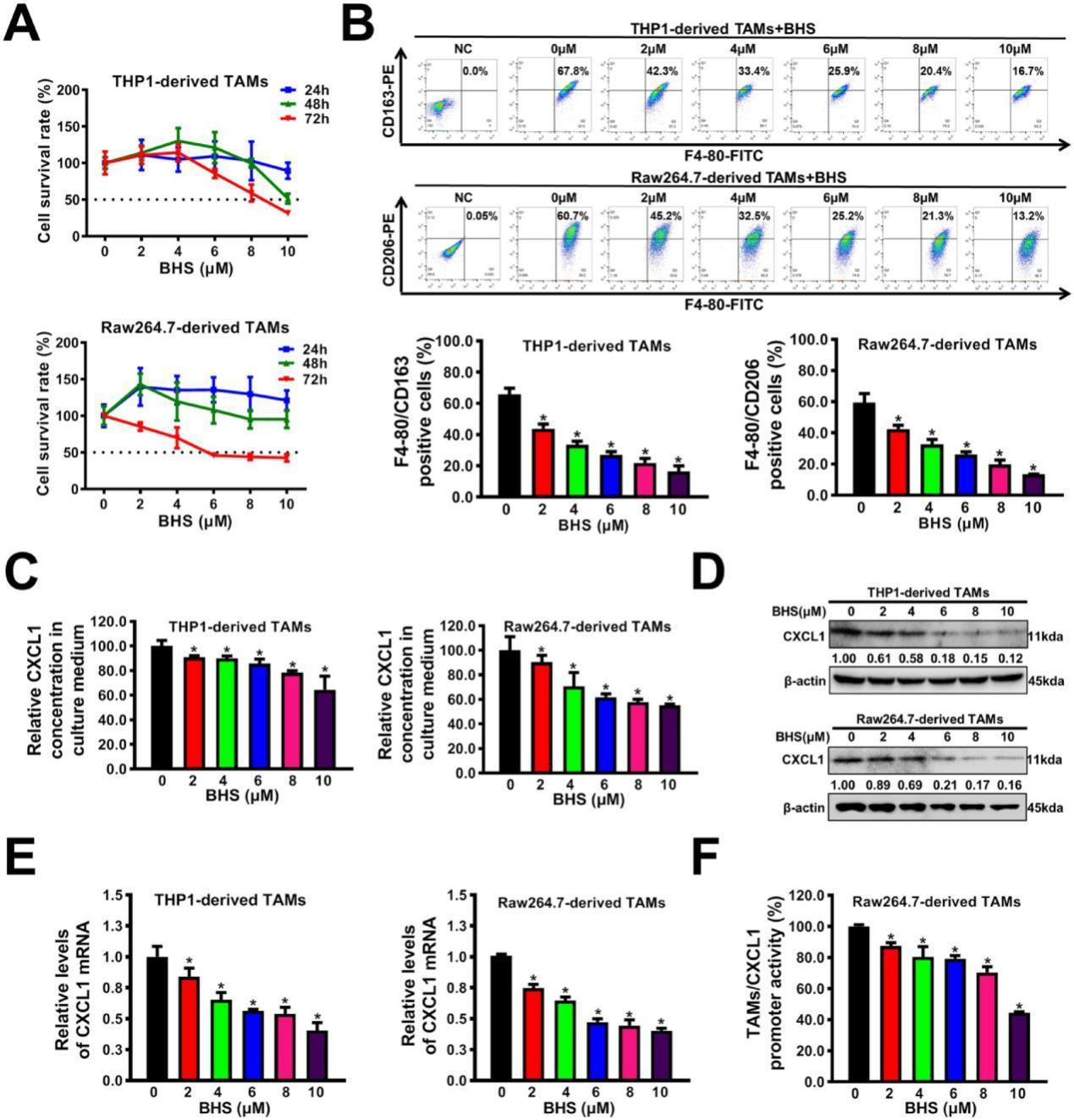
圖4.BHS抑制M2表型極化、CXCL1表達和TAMs的分泌。
三、體內外高效驗證
在動物實驗方面,研究建立了斑馬魚乳腺癌異種移植模型和小鼠乳腺癌異種移植物模型。通過流式細胞術、組織免疫熒光等方法,結果發現,寶藿苷I能夠顯著抑制斑馬魚和小鼠體內乳腺癌的生長和轉移以及TAMs/CXCL1活性。這些實驗結果充分證明了寶藿苷I具有強大的抗乳腺癌轉移能力。并且發現寶藿苷I在斑馬魚胚胎的孵化和發育過程中也沒有表現出明顯的胚胎毒性或致畸作用,胚胎孵化率、畸形率及形態均無顯著變化。BHS也未造成小鼠死亡或體重明顯下降,對肝腎功能也沒有明顯影響,凸顯寶藿苷I金蓉顆粒的安全性。這意味著金蓉顆粒在體內具有較高的安全性。
四、患者福音,或改寫乳腺癌治療格局
寶藿苷I的發現為乳腺癌治療帶來了新的希望。目前,乳腺癌的治療方法主要包括手術、化療、放療等,但這些方法都存在一定的局限性。手術只能切除肉眼可見的腫瘤,對于已經轉移的癌細胞往往無能為力;化療和放療在殺死癌細胞的同時,也會對正常細胞造成損傷,導致一系列的副作用。
寶藿苷I作為一種天然的生物活性化合物,源自藥食同源植物,長期服用無肝腎負擔,具有獨特的抗轉移機制和高安全性,有望成為乳腺增生患者或成高風險人群預防及治療的新選擇。它既可單獨使用,也能PD-1抑制劑、靶向藥聯用,可增強療效,有望破解耐藥難題,尤其適用于三陰性乳腺癌等難治性亞型。
寶藿苷I的發現也為中藥抗癌研究提供了新的思路和方法。傳統中藥是一個巨大的寶庫,其中蘊含著許多具有抗癌潛力的成分。通過現代科學技術的研究和發掘,我們可以從中藥中提取出更多像寶藿苷I這樣的有效成分,為癌癥治療做出更大的貢獻,實現傳統中藥與現代科研的深度融合。
(本文內容源自公開發表的科學研究,用藥請遵醫囑)
參考文獻:Shengqi Wang,Neng Wang,Xiaowei Huang,Bowen Yang,Yifeng Zheng,Juping Zhang,Xuan Wang,Yi Lin,Zhiyu Wang. Baohuoside i suppresses breast cancer metastasis by downregulating the tumor-associated macrophages/C-X-C motif chemokine ligand 1 pathway[J]. Phytomedicine,2020,78..
關注我們:獲取更多抗癌資訊與健康科普
來源: 奇績金蓉


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 奇績仟金方
奇績仟金方 
