預(yù)計未來5年將有更多的ADC藥物獲批上市
撰文 | 李娟
近年來,一種被稱為抗體偶聯(lián)藥物(Antibody-Drug Conjugate, ADC)的新型抗癌藥在臨床實踐中不斷取得突破進展,使其在全球創(chuàng)新藥領(lǐng)域迅速崛起。ADC 是一種什么樣的藥物?它為何能成為抗癌的新希望呢?
相比化療,ADC 藥物有什么優(yōu)勢?
ADC藥物可以形象地理解為殺死腫瘤的精準(zhǔn)導(dǎo)彈。它將細胞毒性藥物直接送入腫瘤細胞,減少了對健康細胞的傷害和副作用。可謂“只打壞人、不誤傷路人”。
ADC的結(jié)構(gòu)由三部分組成:抗體、連接子(linker)和細胞毒性藥物(payload)。其中,抗體是導(dǎo)彈的“導(dǎo)航系統(tǒng)”,負(fù)責(zé)找到腫瘤細胞,并將細胞毒藥運送至其內(nèi);連接子是導(dǎo)彈的“保險裝置”,在合適的環(huán)境(如酸性或特定酶作用下)觸發(fā),釋放與抗體相連的細胞毒藥;細胞毒藥是導(dǎo)彈的“彈頭”,在腫瘤細胞內(nèi)部釋放之后,通過破壞DNA或阻止細胞分裂,直接將其消滅。
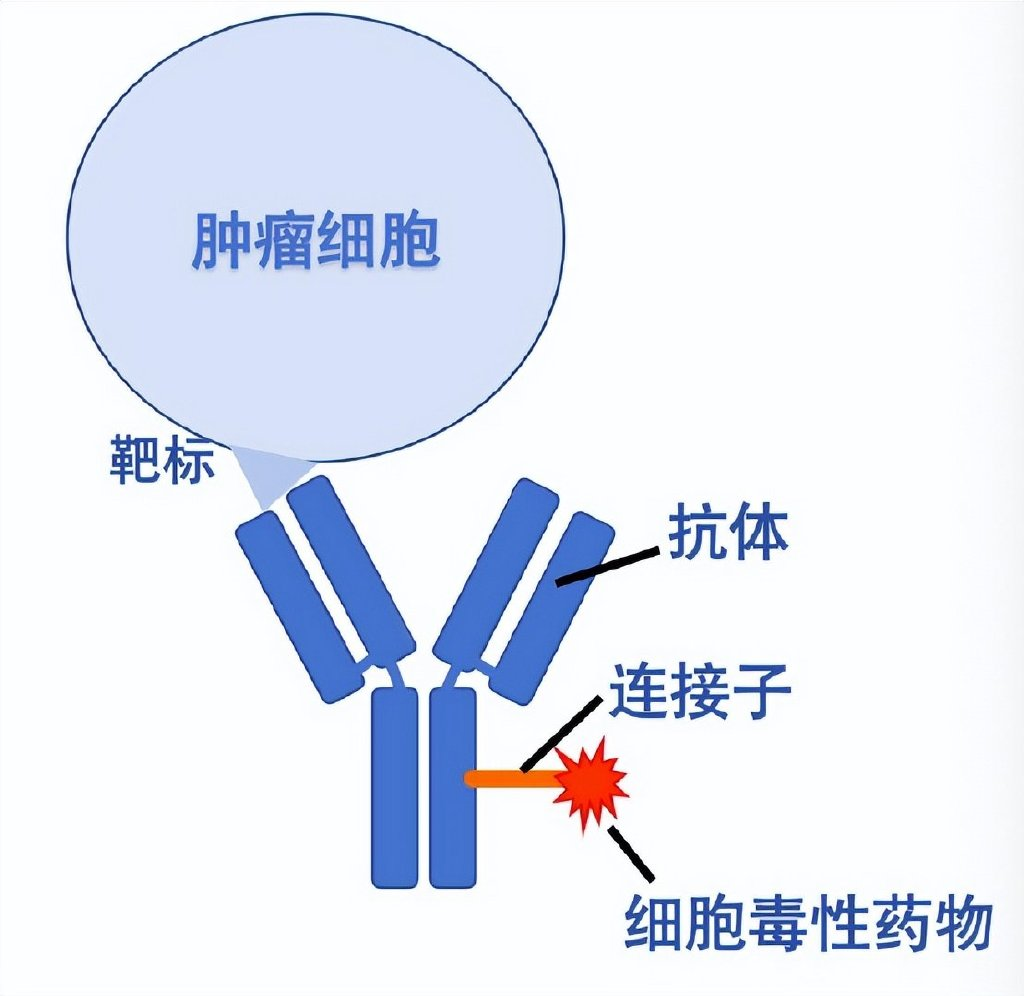
ADC 藥物結(jié)構(gòu)
這套設(shè)計精準(zhǔn)高效,與傳統(tǒng)化療相比,其優(yōu)勢非常明顯。
然而,ADC的發(fā)展是一個漫長而曲折的歷程。
早在20世紀(jì)初,德國物理學(xué)家和科學(xué)家保羅·埃爾利希(Paul Ehrlich)就提出“魔彈”概念,希望研發(fā)能精準(zhǔn)摧毀特定細胞且不傷害正常細胞的藥物。但是這一愿景面臨諸多挑戰(zhàn)。直到20世紀(jì)50年代,化學(xué)技術(shù)突破才使細胞毒性藥物與抗體結(jié)合成為可能。例如,甲氨蝶呤與多克隆抗體結(jié)合實驗標(biāo)志著初步嘗試。
20世紀(jì)70年代,雜交瘤技術(shù)革新推動了單克隆抗體(mAb)的發(fā)展,20世紀(jì)80年代,Greg Winter首創(chuàng)人源化單克隆抗體技術(shù),為ADC奠定基礎(chǔ)。這一時期的ADC在模型中展現(xiàn)良好結(jié)果。但ADC臨床試驗因藥物毒性和療效不足而受挫。
直到2000年,首個ADC藥物——吉妥珠單抗奧唑米星獲美國FDA批準(zhǔn),它最初被用于治療復(fù)發(fā)和/或難治性急性髓系白血病,但因不良事件于2010年撤市。
ADC因其結(jié)構(gòu)復(fù)雜而備受挑戰(zhàn),但該領(lǐng)域的研究從未停滯。在埃爾利希提出“魔彈”構(gòu)想的一個多世紀(jì)后,ADC技術(shù)迎來了新的曙光。
2011年,ADC 藥物布倫妥昔單抗獲批,該藥能夠靶向淋巴瘤細胞表面的蛋白質(zhì)分子CD30來瞄準(zhǔn)并殺傷腫瘤細胞,用于治療霍奇金淋巴瘤和間變性大細胞淋巴瘤。2013年,靶向HER2(部分乳腺癌細胞表面過度表達的蛋白質(zhì)分子)的曲妥珠單抗恩坦辛(T-DM1)獲批治療乳腺癌。這些里程碑式的進展證明了ADC的潛力,并推動了該領(lǐng)域快速發(fā)展。
目前,美國FDA 已批準(zhǔn)的上市ADC藥物多達12種(表1)。中國共有 5 種 ADC 藥物上市。自 2020 年起,Adcetris、Kadcyla、Besponsa、Trodelvy、Enhertu已先后在中國獲批上市。其中,首款由中國公司自主研發(fā)的ADC新藥維迪西妥單抗(Aidixi)于2021 年獲批上市,其胃癌、尿路上皮癌兩項適應(yīng)癥均已進入國家醫(yī)保藥品目錄。近年來ADC領(lǐng)域備受關(guān)注,預(yù)計未來5年將有更多的ADC藥物獲批上市。
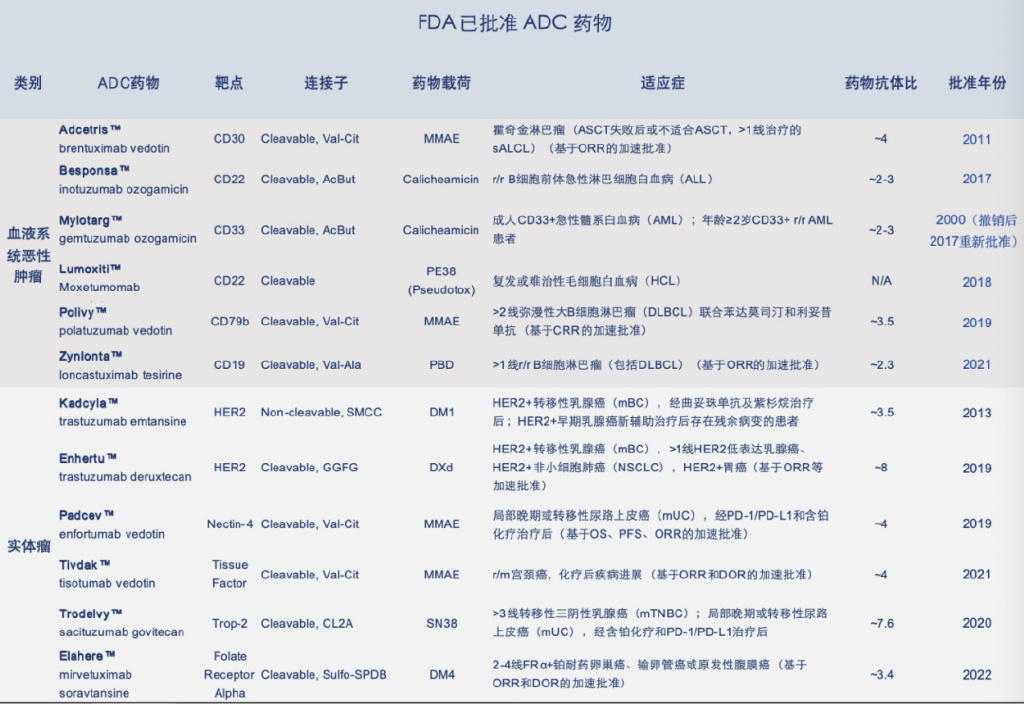
表 1 FDA 已批準(zhǔn)的 ADC 藥物(截至 2024 年 12 月)。其中,靶點是指腫瘤細胞表面抗原分子,藥物載荷是指細胞毒性藥物,藥物抗體比(DAR)是指一個抗體分子所連接的細胞毒性藥物分子的數(shù)量。丨來源:本文作者
ADC藥物是如何殺傷腫瘤細胞的?
作為“精準(zhǔn)打擊腫瘤的導(dǎo)彈”。ADC 是如何發(fā)揮作用的?我們不妨從其“作戰(zhàn)流程”來了解:
首先,ADC注射進入體內(nèi)后,會以三種形式存在。其中,主要活性形式是完整的偶聯(lián)物——抗體和細胞毒藥物通過穩(wěn)定的連接子結(jié)合在一起,確保療效和穩(wěn)定性。此外,還會有一些在生產(chǎn)過程中未能成功結(jié)合藥物的抗體存在。由于連接子不穩(wěn)定,部分細胞毒藥物可能從抗體上脫落,游離在體內(nèi)。
接著,當(dāng)ADC的抗體部分與腫瘤細胞表面的靶點結(jié)合后,整個分子會被細胞“吞噬”并內(nèi)化進入細胞。靶點是否容易被內(nèi)化,以及這種過程的效率,會直接影響ADC的活性。
最后,進入細胞后,ADC會進入細胞的溶酶體或內(nèi)體。在這些環(huán)境中,由于酸性條件、蛋白酶解或化學(xué)反應(yīng),細胞毒性藥物會從抗體上釋放出來。隨后,藥物擴散到細胞質(zhì)中,作用于特定靶標(biāo),最終殺死腫瘤細胞。由于有些ADC的藥物載荷具有疏水性,可以穿透細胞膜。這意味著,即使是那些未表達ADC靶點的鄰近腫瘤細胞,也可能因為藥物擴散而被殺死。這種“旁觀者效應(yīng)”尤其在腫瘤細胞靶點表達不均的情況下顯得尤為重要。
值得說明的是,ADC中的抗體不僅是藥物的“載體”,它本身也有功能:能結(jié)合腫瘤細胞的靶點,干擾腫瘤的信號傳導(dǎo);能與免疫細胞(如自然殺傷細胞,NK)結(jié)合,激活抗腫瘤免疫反應(yīng)——這樣的多重機制可增強 ADC療效。但對某些ADC來說,其具體貢獻仍需進一步研究。
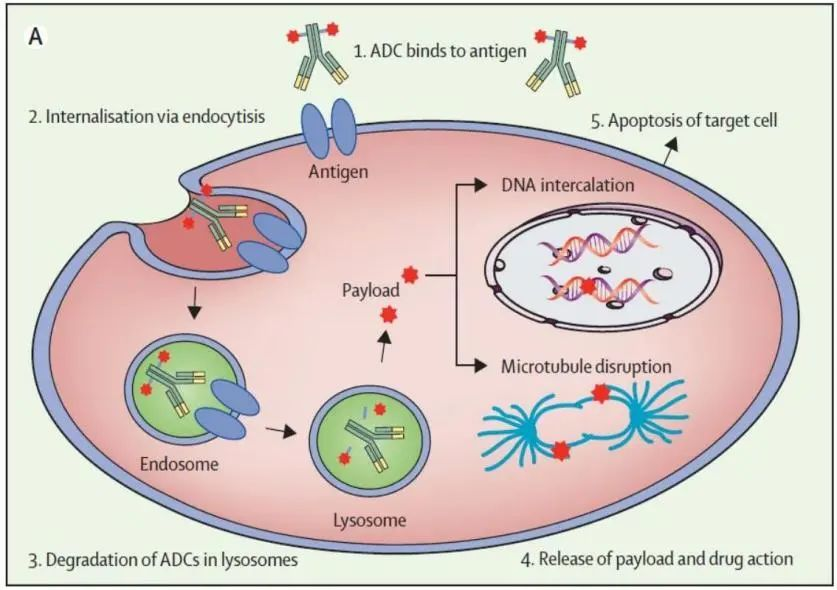
ADC發(fā)揮藥效的主要過程。| 圖源: THE LANCET
如何設(shè)計更好療效的ADC藥物?
通過以上“作戰(zhàn)流程”,我們可以看到,ADC在體內(nèi)的每一步都精細地牽動著療效的天平。對開發(fā)者來說,打造一副精良的ADC“導(dǎo)彈” 會面臨哪些挑戰(zhàn)呢?
首先,要挑對“敵人”,選擇合適的靶標(biāo)。ADC首要任務(wù)是找到并鎖定腫瘤細胞。好的靶標(biāo)就像是腫瘤細胞身上的獨特標(biāo)記,只出現(xiàn)在腫瘤細胞或腫瘤區(qū)域,健康細胞上幾乎沒有,這樣就能確保ADC在執(zhí)行任務(wù)時,盡量不打擾到正常的身體組織。
其次,要打造“導(dǎo)航貨車”,制備高質(zhì)量抗體。這輛“貨車”不僅要能準(zhǔn)確無誤地找到目標(biāo)腫瘤細胞,還要足夠堅固、耐用,具備良好的生物特性,這樣才能確保藥物安全、高效地送達目的地。
第三,要實現(xiàn)精準(zhǔn)對接,保證抗體結(jié)合能力夠強。“貨車”與目標(biāo)的對接是否緊密,直接關(guān)系到ADC能否順利進入腫瘤細胞內(nèi)部,實施“精準(zhǔn)打擊”。如果對接不牢固,ADC可能就會在半路掉鏈子,無法有效進入或消滅腫瘤細胞。
第四,要選擇強力“彈頭”,保證有效載荷的效力。ADC攜帶的細胞毒性“彈頭”必須足夠強大,才能確保一擊即中,殺死腫瘤細胞。但威力過大也可能帶來風(fēng)險,因此需要在效力與安全性之間找到完美的平衡點。
第五,要設(shè)計出靠譜的“橋梁”,選用合適的連接子。連接子就像是搭建在抗體與藥物之間的“橋梁”。它既要足夠穩(wěn)定,保證在血液循環(huán)中不會提前釋放藥物,又要能在進入腫瘤細胞后,適時地釋放“彈頭”,讓藥物發(fā)揮作用。這要求連接子的設(shè)計既要“穩(wěn)得住”,又要“放得開”。
第六,要實現(xiàn)精準(zhǔn)裝載,優(yōu)化藥物與抗體的結(jié)合位點和數(shù)量。藥物與抗體的結(jié)合位點很關(guān)鍵,它影響著藥物的穩(wěn)定性及釋放時機。如果結(jié)合位置不對,藥物可能會過早“脫軌”,增加對健康組織的傷害。而每個抗體上裝載的藥物數(shù)量(DAR)也需謹(jǐn)慎調(diào)控,過少會達不到療效,過多則可能導(dǎo)致ADC不穩(wěn)定,影響療效并增加毒性。
ADC 代表性藥物有哪些?
隨著研究的不斷深入,ADC藥物設(shè)計得到逐代優(yōu)化(表2),不斷涌現(xiàn)出新的研究成果和候選藥物。新一代ADC發(fā)展至今,已實現(xiàn)多項技術(shù)突破。針對構(gòu)成ADC的三部分組件,研究開發(fā)者逐一優(yōu)化提升其性能,使這枚靶向腫瘤細胞的“導(dǎo)彈”更強大:
在抗體方面,采用人源化抗體及位點特異性偶聯(lián)技術(shù),顯著降低了免疫原性,提升了腫瘤靶向性;
在連接子方面,通過引入可切割連接子,能夠在特定條件下可控釋放藥物,增強了治療的精準(zhǔn)性,最新技術(shù)正在進一步優(yōu)化連接子穩(wěn)定性,降低非特異性釋放的風(fēng)險;
在細胞毒性藥物方面,最新技術(shù)采用更強效的細胞毒性藥物,以及多樣化適應(yīng)癥策略,如拓?fù)洚悩?gòu)酶I抑制劑和高藥物抗體載荷,來提高療效。

表 2 ADC 藥物發(fā)展階段特點 | 來源:本文作者
比如說,治療乳腺癌的ADC藥物Enhertu與Kadcyla,代表了HER2靶向ADC技術(shù)不同開發(fā)階段的成果(表3)。Enhertu作為新一代ADC,憑借高藥物抗體比與旁觀者效應(yīng),顯著拓寬了治療范圍,惠及HER2低表達癌癥患者。Kadcyla則是首批成功的HER2靶向ADC,專注HER2陽性乳腺癌治療,技術(shù)成熟且副作用溫和。
2024 年 6 月 2 日,在《自然醫(yī)學(xué)》上發(fā)表了上述兩種 ADC 藥物治療 HER2陽性乳腺癌 和 HER2低表達乳腺癌的關(guān)鍵性臨床試驗(DESTINY-Breast 03)結(jié)果,從中可以看出最新一代ADC藥物的優(yōu)勢。
HER2陽性乳腺癌是一種惡性程度較高的乳腺癌類型,患者體內(nèi)表達大量HER2蛋白,傳統(tǒng)療法(如單抗藥物曲妥珠單抗)雖然能夠靶向HER2,但對于晚期患者或耐藥性病例,效果有限。
在 DESTINY-Breast03 試驗中,Enhertu對HER2陽性、既往接受過多線治療的晚期乳腺癌患者展現(xiàn)了卓越的療效。Enhertu組患者客觀緩解率(ORR)達到78.5%,大幅高于Kadcyla對照組(ORR僅為34.2%);Enhertu組無進展生存期(PFS)達29個月,對照組為7.2個月;Enhertu組中位總生存期為 52.6 個月,對照組為42.7 個月。由此看出,新一代 ADC 藥物Enhertu使患者無疾病進展的時間大大延長,改善了耐藥患者的預(yù)后。
此外,Enhertu在 DESTINY其他的系列試驗中被證明對HER2低表達乳腺癌也具有顯著療效。這種患者群體傳統(tǒng)上不被認(rèn)為適合HER2靶向治療,但Enhertu打破了這一限制,將精準(zhǔn)醫(yī)學(xué)的理念進一步擴展到更多患者群體。
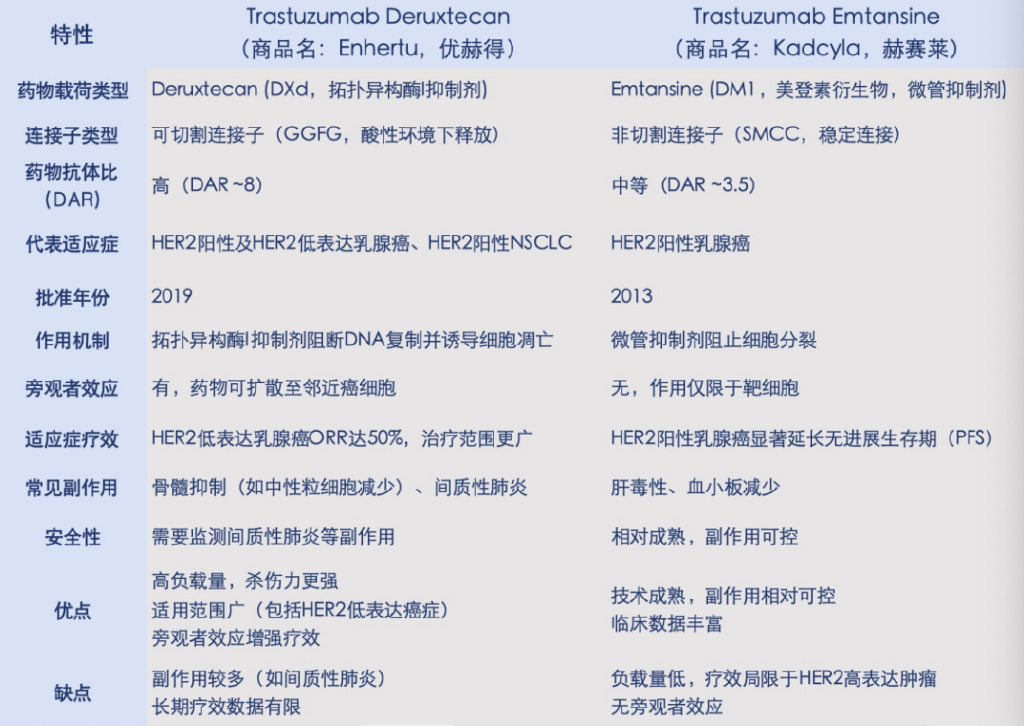
表3 靶向HER2的ADC代表藥物比較。
結(jié)語
由上述例子可知,ADC藥物重新定義了癌癥治療的可能性,它以卓越的精準(zhǔn)性、強大的殺傷力和創(chuàng)新的設(shè)計理念,堪稱現(xiàn)代醫(yī)學(xué)與科學(xué)技術(shù)的完美融合。
隨著ADC藥物市場的競爭日益激烈,如何在眾多候選藥物中脫穎而出,成為開發(fā)者們必須面對的關(guān)鍵問題。如何進一步優(yōu)化脫靶毒性,減少潛在的毒副作用,仍是當(dāng)前研究的重點。為了構(gòu)建核心競爭力,開發(fā)者們需要在靶點選擇、平臺技術(shù)、適應(yīng)癥選擇、臨床設(shè)計以及項目規(guī)劃等方面進行全面創(chuàng)新和優(yōu)化。只有這樣,才能將更高療效的ADC引入臨床實踐,為癌癥患者帶來更多福音。
注:本文封面圖片來自版權(quán)圖庫,轉(zhuǎn)載使用可能引發(fā)版權(quán)糾紛。

特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閱不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關(guān)注公眾號,回復(fù)四位數(shù)組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權(quán)說明:歡迎個人轉(zhuǎn)發(fā),任何形式的媒體或機構(gòu)未經(jīng)授權(quán),不得轉(zhuǎn)載和摘編。轉(zhuǎn)載授權(quán)請在「返樸」微信公眾號內(nèi)聯(lián)系后臺。
來源: 返樸
內(nèi)容資源由項目單位提供


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 返樸
返樸 
