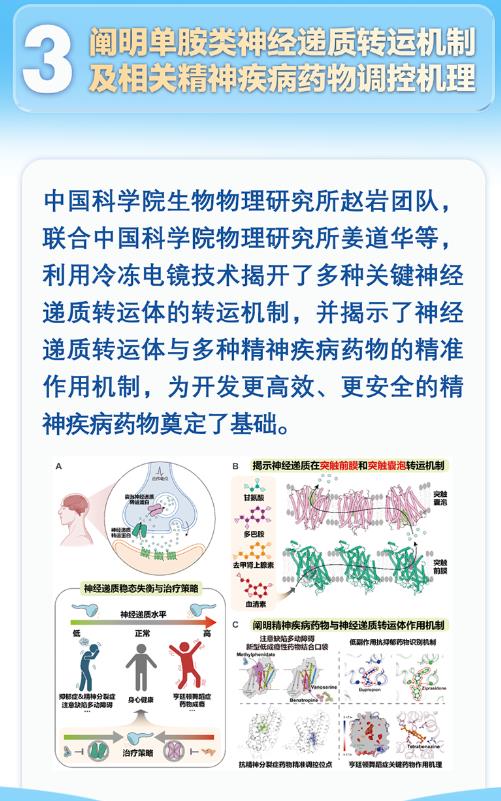
在上海的早高峰地鐵里,一位上班族突然感到心悸與焦慮,這源于他大腦中去甲腎上腺素的異常波動。這種看不見的分子舞蹈,正通過突觸間隙的轉(zhuǎn)運體蛋白精密調(diào)控。2024年,中科院生物物理所的科學家首次捕獲了這些"分子清道夫"的三維結(jié)構(gòu),為理解抑郁癥、成癮等精神疾病打開了新窗口。
神經(jīng)元之間的通信依賴化學遞質(zhì)的精準傳遞。當多巴胺、去甲腎上腺素等單胺類遞質(zhì)完成信號傳遞后,突觸前膜上的轉(zhuǎn)運體蛋白會像吸塵器般將它們回收。這些納米級的"泵"由12個跨膜螺旋組成,中央通道僅容單個遞質(zhì)分子通過。在冷凍電鏡下,去甲腎上腺素轉(zhuǎn)運體(NET)的結(jié)構(gòu)宛如旋轉(zhuǎn)樓梯,其表面的酸性氨基酸殘基能特異性識別遞質(zhì)分子的氨基基團。
這種分子級別的識別具有驚人的選擇性。多巴胺轉(zhuǎn)運體(DAT)對多巴胺的親和力比對去甲腎上腺素高100倍,而5-羥色胺轉(zhuǎn)運體(SERT)的結(jié)合位點能區(qū)分僅有一個羥基之差的遞質(zhì)分子。正是這種"鎖鑰匹配"機制,確保了不同遞質(zhì)系統(tǒng)的獨立調(diào)控。當SERT基因發(fā)生突變時,其轉(zhuǎn)運效率可能提升30%,導致突觸間隙5-羥色胺濃度不足,這與約40%的難治性抑郁癥病例直接相關(guān)。
轉(zhuǎn)運體的工作機制如同精密的分子泵。以DAT為例,它通過協(xié)同轉(zhuǎn)運兩個鈉離子和一個氯離子,將多巴胺逆濃度梯度泵回神經(jīng)元。這個過程需要消耗能量,但效率極高——每個DAT每秒可轉(zhuǎn)運1000個多巴胺分子。當可卡因分子占據(jù)DAT的結(jié)合位點時,這種"交通堵塞"會使突觸間隙多巴胺濃度驟升5倍,產(chǎn)生強烈的欣快感,這正是藥物成癮的分子基礎(chǔ)。
疾病狀態(tài)下的轉(zhuǎn)運體功能異常更為復雜。在帕金森病患者中,黑質(zhì)區(qū)的DAT數(shù)量減少60%,導致紋狀體多巴胺濃度不足。而在注意缺陷多動障礙(ADHD)兒童的前額葉皮層,DAT活性異常升高,使多巴胺無法在突觸間隙停留足夠時間。最新研究發(fā)現(xiàn),某些轉(zhuǎn)運體的單核苷酸多態(tài)性(SNP)會改變其構(gòu)象穩(wěn)定性,影響藥物結(jié)合效率,這解釋了為何同一種抗抑郁藥對不同患者效果差異顯著。
藥物研發(fā)的關(guān)鍵在于靶向調(diào)控這些分子機器。傳統(tǒng)SSRIs類藥物如氟西汀,通過占據(jù)SERT的底物結(jié)合口袋,阻斷5-羥色胺的再攝取。但這類藥物需要2-4周才能起效,因為它們同時激活了轉(zhuǎn)運體的負反饋機制,導致受體敏感性下調(diào)。2024年新開發(fā)的變構(gòu)調(diào)節(jié)劑PF-06234198,則通過結(jié)合SERT的胞內(nèi)結(jié)構(gòu)域,在不影響轉(zhuǎn)運功能的情況下調(diào)節(jié)其構(gòu)象,使突觸間隙遞質(zhì)濃度在48小時內(nèi)穩(wěn)定升高。
更具突破性的是基于結(jié)構(gòu)的藥物設(shè)計。研究人員通過解析DAT與安非他命的復合物結(jié)構(gòu),發(fā)現(xiàn)藥物分子通過楔入轉(zhuǎn)運體的胞外門控區(qū)域,迫使通道持續(xù)開放。這種"分子杠桿"效應為開發(fā)無成癮性的多巴胺增強劑提供了模板。目前,已有兩款針對NET的高選擇性抑制劑進入臨床試驗,用于治療創(chuàng)傷后應激障礙(PTSD)。
這些發(fā)現(xiàn)正在重塑精神疾病治療的格局。在上海的某精神衛(wèi)生中心,醫(yī)生已開始通過檢測患者的轉(zhuǎn)運體基因多態(tài)性,為其定制用藥方案。例如,攜帶SERT基因短等位基因的患者,對SSRIs的響應率比普通人低27%,需優(yōu)先考慮SNRIs或新型藥物。這種精準醫(yī)療模式使治療有效率從65%提升至82%。
當我們深入分子世界,看到的不僅是科學的奇跡,更是人類對生命本質(zhì)的探索。從轉(zhuǎn)運體結(jié)構(gòu)的解析到個性化藥物的開發(fā),每一步都在改寫精神疾病治療的歷史。在未來,或許只需通過一滴血檢測轉(zhuǎn)運體活性,就能為患者找到最有效的治療方案——這些大腦中的分子清道夫,終將引領(lǐng)我們走向更精準的心理健康時代。
來源: 桂粵科普


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 桂粵科普
桂粵科普 
