在我們的體內,衰老細胞是衰老的“關鍵操控者”,決定著身體走向衰老的速度。這些細胞隨著年齡的增長而逐漸積累,它們不再正常分裂,喪失了原有的功能,并且開始分泌一系列有害物質。這些衰老細胞被認為是引發衰老和多種疾病的“罪魁禍首”,如心血管疾病、糖尿病、關節炎和神經退行等疾病。
近期,中國科學院分子細胞科學卓越創新中心的一項開創性的研究發現,通過激活VEGF信號通路,可以改善內皮細胞的功能,減少肝臟中的老化現象。這一發現為針對不同衰老細胞類型的精確治療提供了理論基礎。這項研究為清除衰老細胞分泌的有害細胞提供了新的希望,讓我們看到了治療相關疾病甚至延緩衰老的可能。

實驗設計與過程
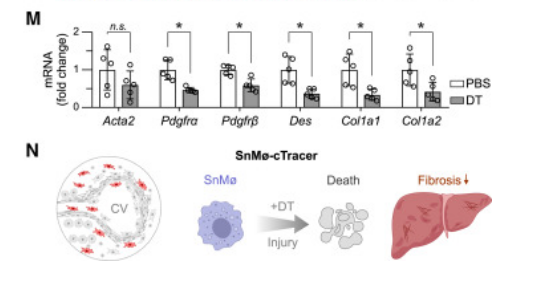
研究人員首先創建了一種特殊的小鼠模型,其可以在小鼠體內的p16Ink4a細胞上標記一個“熒光標簽”。p16Ink4a是一種廣泛認可的衰老細胞標志物,它的表達通常與細胞的衰老狀態密切相關。通過這種方法,研究人員能夠實時追蹤和觀察這些衰老細胞在不同器官中的分布和行為。
在實驗中,研究人員對小鼠進行了化學損傷,以模擬人類肝臟損傷的情況。這種損傷導致肝臟中出現大量衰老細胞,這些細胞被“熒光標簽”標記,從而使得研究人員能夠清晰地觀察到它們。他們發現,在受損的肝臟中,標記了熒光的衰老細胞主要是巨噬細胞和內皮細胞。這些細胞在肝臟修復過程中發揮了重要作用,但它們的積累也導致了肝臟功能的下降。
為了測試是否可以通過改變這些細胞的行為來改善肝臟損傷,研究人員采用了基因工程技術。他們創建了一種新的小鼠模型,能夠特異性地在內皮細胞中過表達一種叫做Kdr的基因。Kdr基因編碼的蛋白質是血管內皮生長因子受體,對血管生成和修復至關重要。

實驗結果顯示,通過表達Kdr基因,內皮細胞在受損肝臟中的數量增加,新血管的形成也顯著提高。這一發現具有重要意義,新血管的生成對于受損組織的修復至關重要。更重要的是,這種基因操作減少了肝臟中的纖維化區域,纖維化是肝臟損傷長期無法修復的后果,也是肝硬化等嚴重疾病的主要特征。
這些發現表明,通過特定的基因編程,我們或許能夠清除或改造衰老細胞,從而在一定程度上延緩衰老進程,治療與衰老相關的疾病。研究人員進一步分析了這些基因改造細胞的具體作用機制,發現它們不僅促進了血管生成,還減少了炎癥反應,提高了組織的再生能力。
對未來研究的展望
傳統的衰老細胞清除策略通常是“一刀切”的方式,但新的研究表明,這種做法可能并非最佳。針對巨噬細胞和內皮細胞的不同功能,研究人員提出了更為精細的治療策略。未來的研究將致力于以下幾個方向:
1.細胞類型特異性清除:開發能夠特異性識別和清除特定衰老細胞類型的方法。
2.分子機制的解析:深入理解衰老細胞的功能和它們在衰老過程中的作用。
3.臨床應用的探索:將實驗室的研究成果轉化為臨床上的有效治療手段。
參考文獻:Zhao H,Liu Z,Chen H,et al.Identifying specific functional roles for senescence across cell types.[J].Cell,1970,25:7314-7334.e21.
來源: 康迅網


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 康迅網
康迅網 
