1. 鉭的發現及基本性能
瑞典化學家A. G. Ekaberg于1802年在一種鉭鈮礦中通過化學反應發現了一種金屬元素,并參考西方神宙斯兒子的名字(Tantalus)命名該元素為Tantalum(鉭)[1]。鉭是元素周期表第73號元素,位列第六周期第五副族,位于鈮元素的下一周期。由于鉭和鈮的化學性質十分相近,且常被發現在同一種礦石中,19世紀前的人們常誤認為兩者是同一元素。直到1844年,德國化學家Heinrich Rose通過化學方法證明兩者是不同元素,鉭的面紗才逐漸被揭曉[2]。
如圖1(a),鉭金屬呈銀白色,密度為16.654 g/cm3,其高密度與相對原子質量、原子半徑及原子體積相關。鉭原子相對原子質量約為180.95[3],原子體積為10.9 cm3/mol,原子半徑為0.146 nm,每單位原子體積所具有的相對原子質量大,因而其密度高。如圖1(b),鉭具有體心立方的晶格結構,原子間排列緊密,滑移系較多,因此鉭的延伸性能較好。鉭原子間金屬鍵合結合能大,破壞金屬鍵合需要的能量較大,導致其熔點高達2997 °C。此外鉭具有低膨脹系數,約為7×10–6 ℃–1,低于金銀鋁銅鐵等常見金屬。
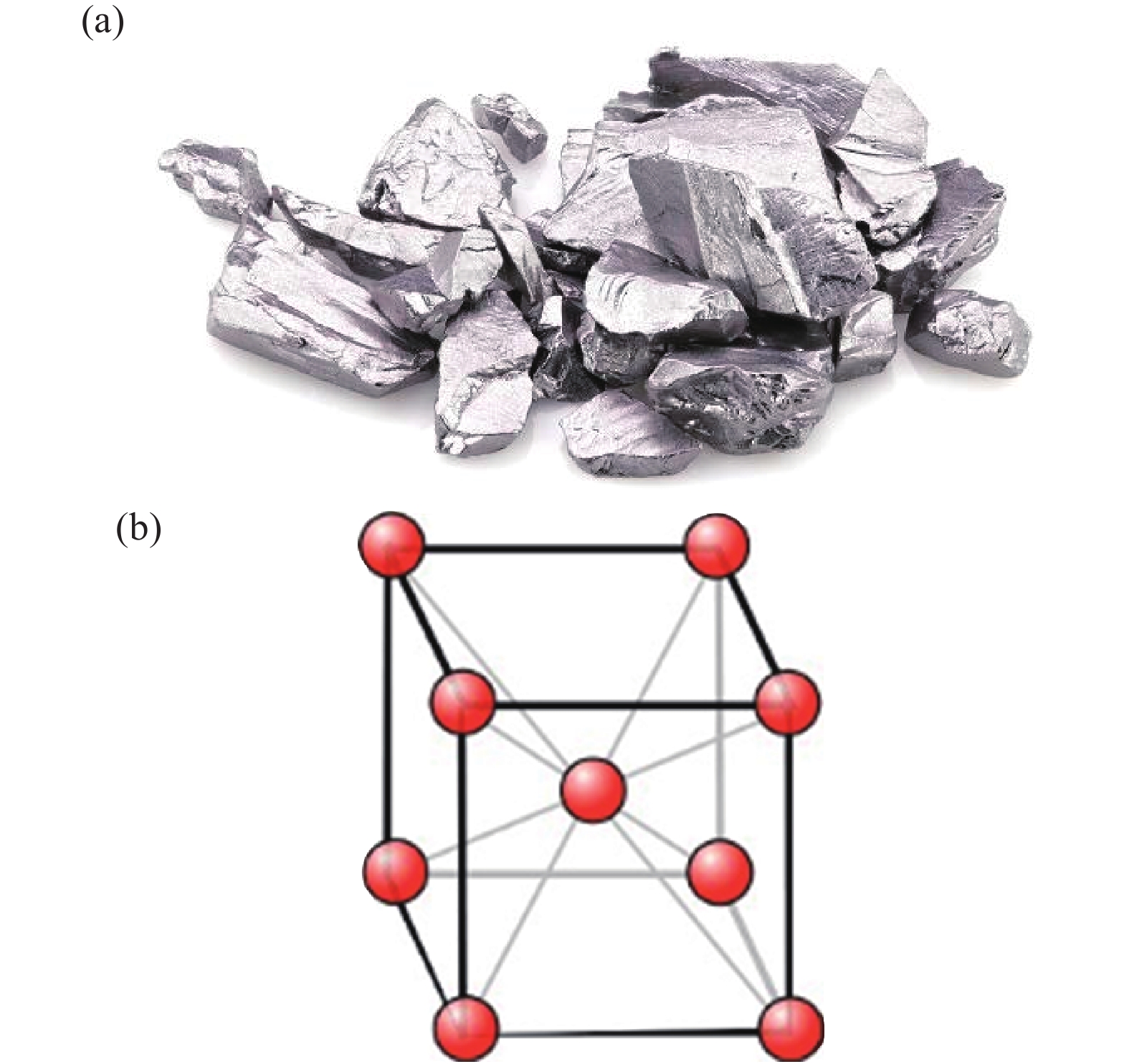
圖1 金屬鉭相關信息:(a)純鉭塊體;(b)晶體結構
2. 鉭礦分布、冶煉及鉭的應用
地殼中鉭元素含量較少,約為地殼質量的0.0002%,目前,全球已探明鉭的可開采量約為14萬t,主要集中在澳大利亞和巴西,約為13.9萬t。由于礦物沖突等問題,世界上只有極少數國家具有開采鉭礦的能力,其中剛果、巴西、盧旺達和尼日利亞為生產鉭礦最多的幾個國家,4國產量占世界總生產量的80%以上。我國鉭礦主要分布在江西、內蒙古和廣東3個省區,儲存量占全國鉭礦的72.6%。江西宜春鉭鈮礦有限公司和寧夏東方鉭業股份有限公司分別是我國最大的鉭鈮選礦廠和最大的鉭產品生產公司。據2022年年度統計,我國礦山產量約78 t,鉭相關產品及原料進口量為8645.9 t,而出口量為805.9 t。我國仍是世界上最大的鉭進口國家,全球30%的鉭金屬和礦石等鉭產品被我國采購[4]。
鉭鐵礦、鈮鐵礦和鈳鉭鐵礦是冶煉鉭的主要原材料,由于我國鉭礦料含有較多錳、鈦和鎢等雜質元素,品位較低,因此需要先將粗礦粉碎,并通過以密度為分選依據的重選法、以比磁感應強度為分選依據的磁選法和以化學反應發生與否為分選依據的化學選礦法等選礦方法挑選出精礦。接著添加硫酸、氫氟酸和硝酸等混合酸將鉭溶解以進一步分離鉭和其他元素。此時,金屬鉭變成了離子狀態,需使用沉淀劑處理形成氫氧化鉭沉淀,再干燥煅燒形成氧化鉭,最后在高溫下加入還原劑鈉或鉀與氧化鉭反應生成金屬鉭[5]。
鉭具有良好的高溫力學性能以及抗蠕變性能,制備成的Ta–W和Ta–Hf系合金可用作航空航天領域中的高溫結構材料[6];鉭的綜合力學性能較好,其碳化物硬度很高,與WC相當,能被用來制作切削刀具(圖2(a))。鉭的氧化膜具有高介電常數,因此在電容器裝備中也得到了應用(圖2(b))[7];鉭的熱膨脹系數較低,硬度高,受溫度和外力影響變化小,適合制備精密儀器。純鉭易氧化形成Ta2O5致密的表面氧化膜,在腐蝕環境中可以隔絕基體與腐蝕溶液。常溫下該氧化膜除了與少數混酸發生反應無法共存外,能在整個pH值范圍內穩定存在,因此在工業裝備上也出現了鉭的身影。如圖2(c)所示,鉭箔片由于優異的高溫性能,可用作真空爐和隔熱應用中的內襯。此外,鉭在人體體液中無細胞毒性、不釋放有害元素且不被人體吸收,表現出優異的細胞相容性和生物穩定性,同時,鉭還具有優異的細胞附著性,因此其在醫療領域的潛力得到了廣泛的關注。圖2(d)是醫用鉭鈦復合材料[8],鉭作為涂層可提升合金的生物相容性。然而涂層與基體材料特性存在差異,表面改性涂層通常表現出較差的粘結強度,且涂層在使用過程中容易受到破壞而限制其作用[9]。在醫療行業,使用鉭作為主要原材料,即制備全鉭骨植入器械,是克服上述缺點的有效途徑。但是由于鉭的高熔點及對氧親和力大等特點,使用傳統加x工方法加工難度大、生產效率和材料利用率低,大大提高了鉭植入器械的制備成本,增加病人負擔,因此亟需一種新工藝來實現全鉭骨植入器械的高效精準成形。

圖2 鉭在不同領域的應用:(a)切削刀具;(b)電容器;(c)高溫隔熱內襯;(d)金屬植入體[7–8]
3. 3D打印鉭
3D打印是一種新型加工方法,該技術最顯著的特點是可以根據所導入的工件模型,直接形成最后的三維樣品。3D打印中的激光粉末熔化技術(Laser Powder Bed Fusion, LPBF)和電子束粉末熔化技術(Electron Beam Melting, EBM)常被用于加工鉭植入器械,LPBF加工示意圖如圖3所示[10]。LPBF加工設備有3個倉室,分別為粉料倉、成形倉和回收倉,打印前需提前將金屬粉末加入粉料倉,加工時,粉末被刮刀均勻鋪展在成形倉中,再由激光或電子束熔化加熱后凝固成預先設定好的形狀。粉末倉逐層上升,成形倉逐層下降,層層疊加最后成形[11]。
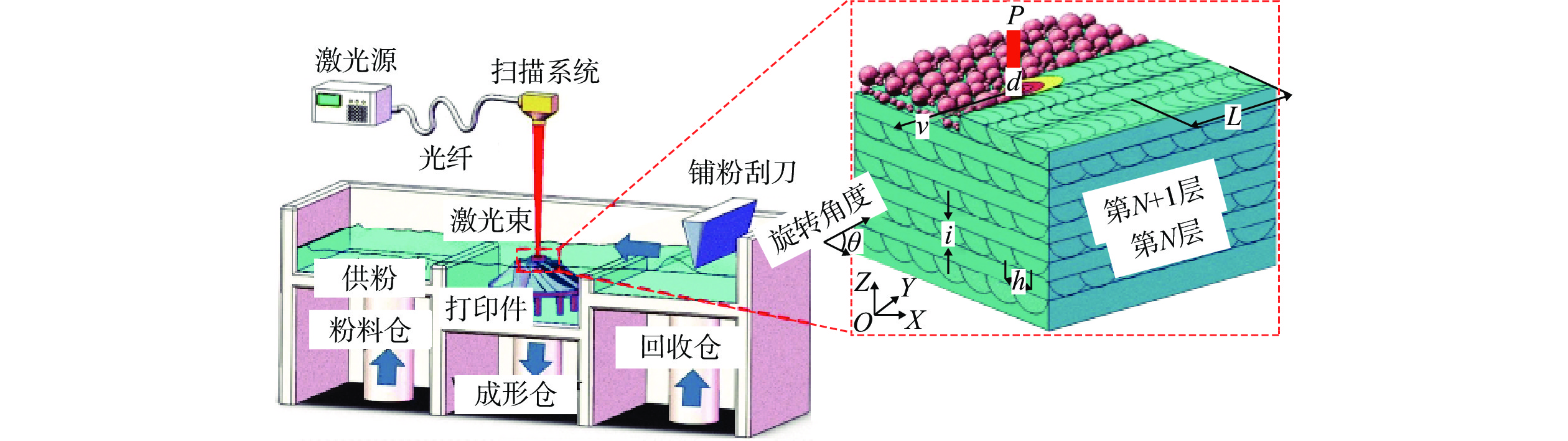
圖3 LPBF加工示意圖[10]
LPBF技術可以根據患者治療區域,定制形狀大小匹配的金屬骨植入體,滿足患者個性化定制需求。加工時高能量密度的激光束會按照模型設計的軌跡逐層掃描,各層精準疊加成目標形狀,實現工件結構的設計自由[12]。鉭的熔點高,傳統加工方法加工鉭效率太低,LPBF加工過程中瞬間釋放的高能激光束能充分且快速地使難熔鉭粉熔化,大大降低了制備生物醫用鉭的難度,提高植入體制備效率,縮短術前準備周期。加工過程中未用完的粉末可回收利用,且打印樣品精度高,后續僅需要少量的銑削加工,材料利用率高,大大降低鉭植入體的制造成本。此外,LPBF可以實現多孔結構的快速制備,有效解決實體鉭植入器械質量過重和力學性能不匹配的問題。
4. 3D打印醫用鉭的影響因素
通過3D打印制備的鉭醫用金屬植入體需要不斷優化力學性能和生物性能以滿足實際應用過程中的需求并規避潛在的風險。現階段,3D打印鉭需要在以下2個方面得到進一步的提升:
(1)植入體需要滿足不同患者個性化需求,與不同受損部位和畸形骨實現良好匹配,因此產品的加工工藝應具備高自由度從而減少對產品形狀和尺寸設計的限制。植入體在植入人體后需要發揮基本的力學支撐作用,因此材料應具備良好的強度與韌性。3D打印制備的鉭醫用金屬植入體的力學性能與加工粉末的質量、加工參數及熱處理相關,可通過調節相應的工藝參數獲取合適的力學性能,然而工藝參數與材料的實際成形性能和服役表現的作用關系仍不明確,有待進一步探究。
(2)植入體需要在人體內長期服役,對人體組織細胞的影響應盡可能小,避免出現感染。現階段,大多數研究對結構進行調控,以提升鉭植入體的生物性能,然而3D打印鉭金屬的結構設計目前仍需要進一步研究。
人體骨根據結構可分為皮質骨和松質骨,皮質骨較為致密堅硬,位于骨骼外層;松質骨呈現三維網狀小梁結構,位于骨骼芯部。純鉭的彈性模量一般超過100 GPa,遠大于松質骨(0.01~1.57 GPa)和皮質骨(5~23 GPa)彈性模量[13]。植入體和人體骨彈性模量不匹配,在承受應力時會產生不同的應變從而導致骨與骨之間相對位移,長期植入會引起“應力屏蔽”效應。植入體承受大部分的應變,可能會發生變形,影響服役壽命與性能;人體骨長期缺乏壓力刺激,會導致成骨細胞活性降低,造成人體骨廢用性萎縮。將金屬植入體設計成多孔結構,通過調節多孔結構形狀及孔隙率,可以改變彈性模量大小,并為骨細胞長入和粘附提供更多位置,有利于植入體與松質骨緊密結合。
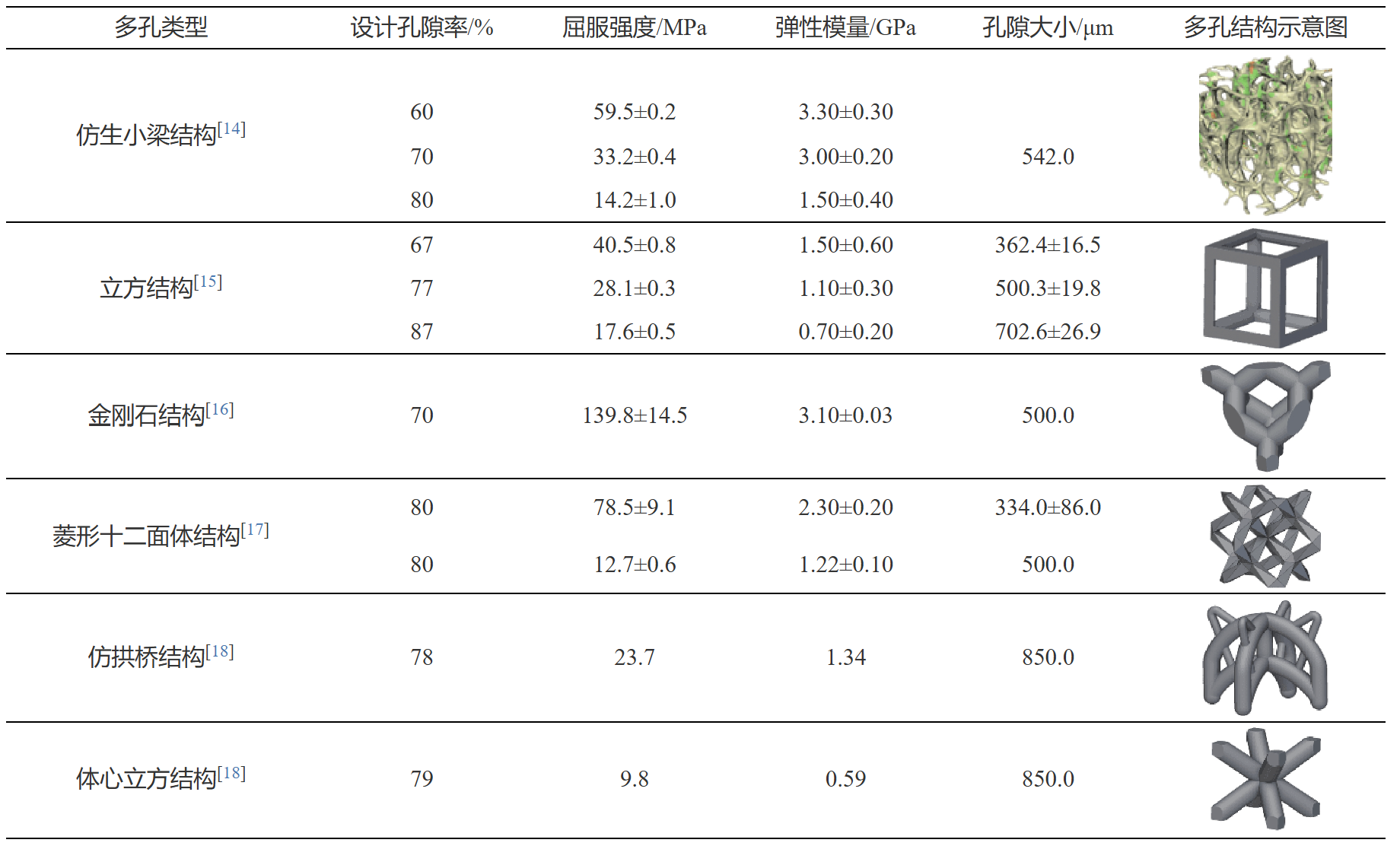
常見的多孔結構設計有仿生小梁結構、金剛石結構和菱形十二面體等結構,通過LPBF制備的多孔鉭對應設計尺寸及力學性能如表1所示。綜合分析,仿生小梁和立方結構的彈性模量與松質骨更貼合,屈服強度值也相對較高[14]。仿生小梁結構表面積更大,與松質骨的結合會更牢固,目前市場商業化多孔鉭結構以小梁結構為主。
表1 多孔鉭設計尺寸及力學性能
5. 3D打印醫療鉭植入體案例
隨著醫療水平的不斷進步及《中國制造2025》的實施,以增材制造為代表的新型制備工藝推動了我國骨科植入體市場蓬勃發展。自2015年起,我國成為世界上第二大骨植入體消費國。目前骨植入體產品根據使用場景可分為脊柱類、關節類和創傷類,其中髖臼杯(關節植入物)和椎間融合器(脊柱植入物)的商業化發展最快。骨植入體制造材料包括金屬、陶瓷、高分子和碳質材料,其中鉭作為金屬骨植入體中的一員,具有極大的發展潛力。
5.1 脊柱類產品
3D打印全鉭脊柱植入器械的臨床研究在國內已開展。2021年7月,空軍軍醫大學西京醫院將3D打印鉭錐體植入患者錐體缺損部位(圖4(a)),以促進缺損部位快速愈合。由于患者椎部有腫瘤持續壓迫脊柱,需要進行三節段脊椎腫瘤后路整塊切除,并需植入體對缺損部位進行支撐。鉭錐體相對于常見的鈦植入體具有更好的促骨長入能力,彈性模量與人體骨更匹配[19],因此最終該醫院選用鉭人工椎體作為植入體。該臨床植入案例的成功證實了3D打印全鉭植入器械的性能和實際操作的可行性(圖4(b))。

圖4 3D打印鉭人工椎體:(a)打印成品;(b)植入人體后X光照片[19]
隨著3D打印全鉭脊柱植入器械的發展,鉭椎間融合器于2023年1月獲得中國國家藥品監督管理局(National Medical Products Administarion, NMPA)的三類醫療器械許可[20]。鉭椎間融合器作為國內首款通過LPBF制備并獲得NMPA批準的鉭骨科植入體,標志著其產品化的成功和較高的醫療應用價值。該鉭椎間融合器產品具有小梁結構,可實現68%~78%的高孔隙率,以促進骨組織和血管融合;彈性模量與人體松質骨相當,具有出色的穩定性和生物力學相容性(圖5(a))。2023年3月,武漢協和醫院成功將鉭金屬椎間植入體應用于脊椎手術,術后患者恢復良好,頸部疼痛癥狀得到緩解(圖5(b))。
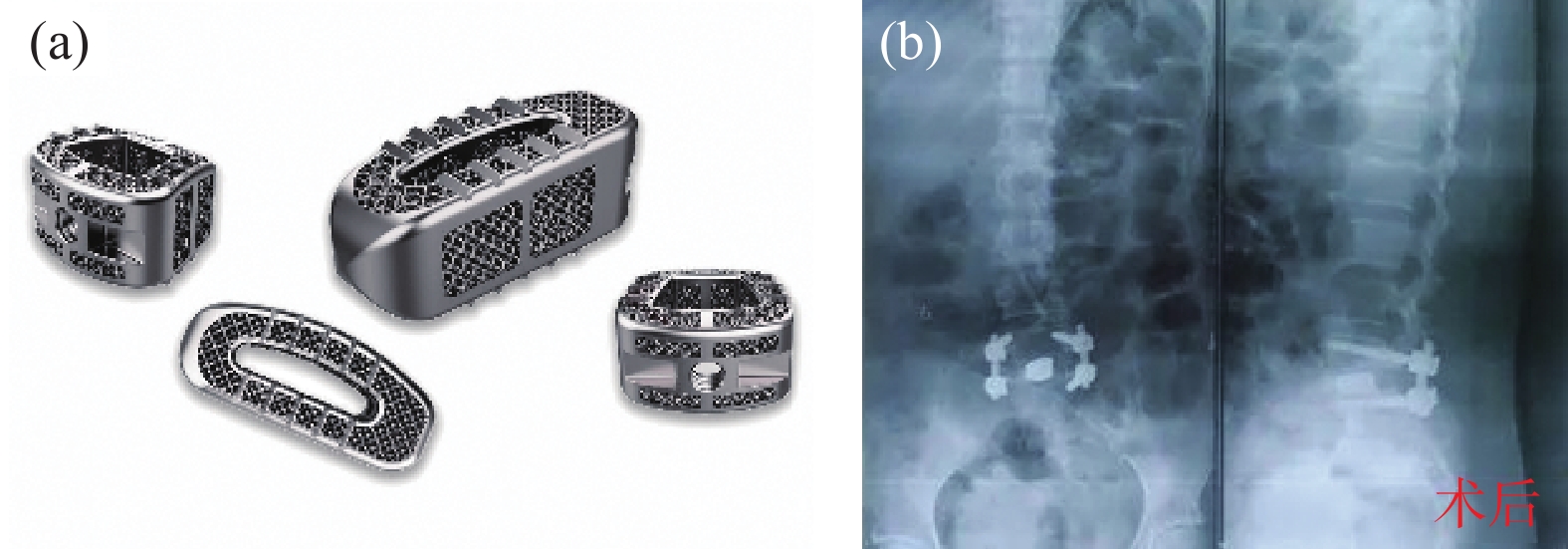
圖5 3D打印鉭椎間融合器:(a)打印成品;(b)植入人體后X光照片[20]
5.2 關節類產品
鉭關節類植入器械的臨床研究開展較早。2017年,陸軍軍醫大學通過3D打印制備了鉭膝關節墊塊(圖6(a)),并對84歲的患者進行了置換手術。3D打印前,先基于患者CT掃描結果構建植入體模型,并在計算機模擬了假體植入情況,經過反復模擬并修改,然后進行個性化打印。通過個性化定制的產品表面粗糙且具備小梁結構,有助于植入體與人體骨的長期穩定,術后效果良好(圖6(b))[21]。
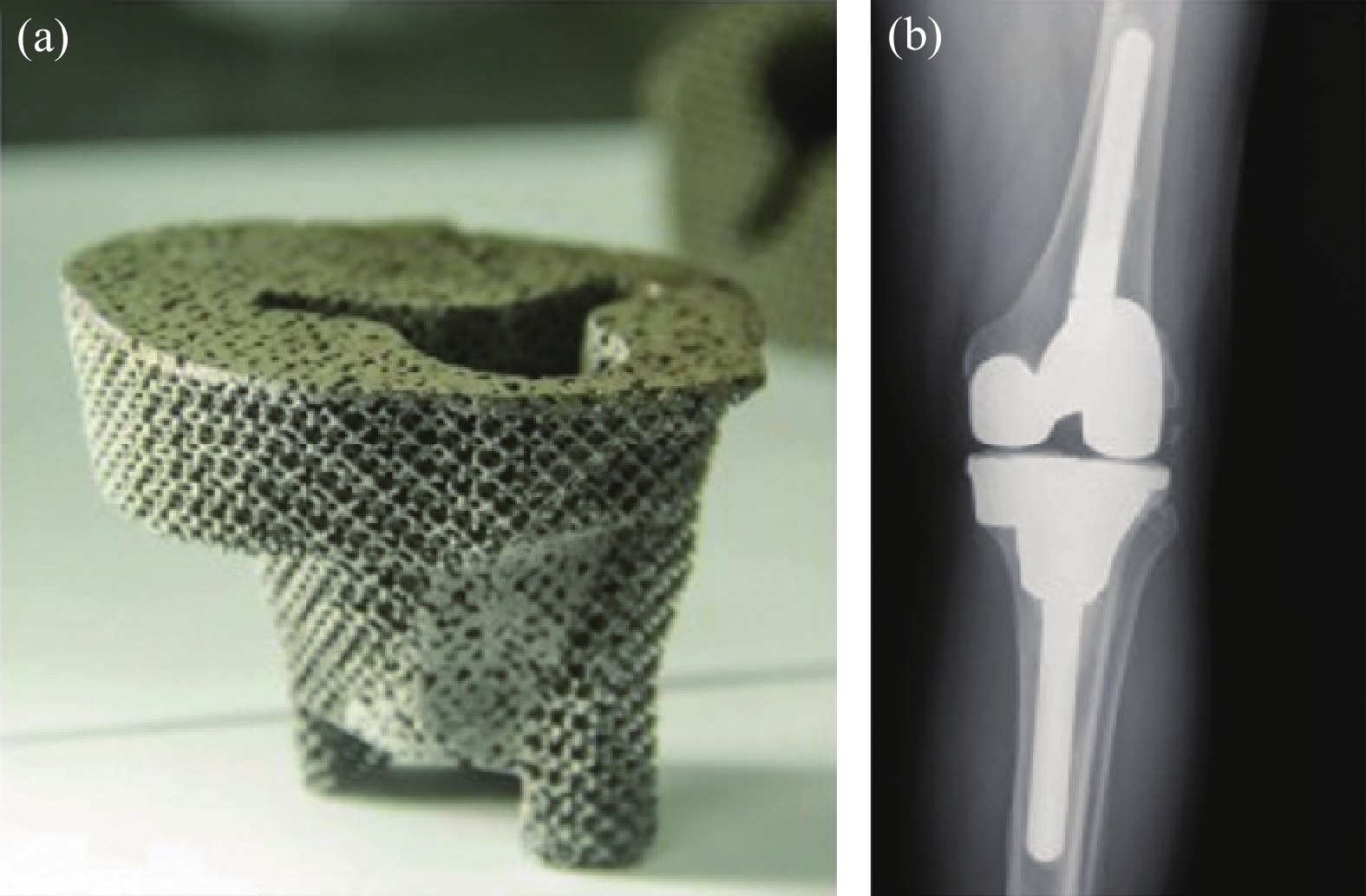
圖6 3D打印鉭金屬膝關節墊塊:(a)打印成品;(b)植入人體后X光照片[21]
近三年來,大連大學附屬中山醫院完成了多例3D打印多孔鉭關節植入手術,包含髖關節、腕掌關節及踝關節等,促進了鉭植入體的發展。2021年,大連大學附屬中山醫院為一位股骨頭缺損并患有慢性關節感染的患者進行3D打印鉭金屬髖關節植入(圖7)[22]。為了解決植入后的關節感染問題,該醫院選擇3D打印多孔鉭金屬假體,并利用多孔結構的孔隙搭載抗生素。由于鉭在體液中不降解,能長期為患者提供支撐,搭載在植入體上的抗生素局部緩慢釋放,能起到長期抗菌作用;設計的多孔結構有利于骨組織長入鉭植入體及抗生素的傳遞。該研究通過對鉭金屬外加抗菌藥物,解決了實際應用過程中的感染問題,為后續鉭金屬成分設計提供了新的思路。

圖7 3D打印鉭金屬髖關節[22]
2021年11月,大連大學附屬中山醫院根據患者指掌關節半脫位,保守治療無法根治疼痛等現狀,對患者進行了3D打印多孔鉭植入手術(圖8(a))[23]。腕掌關節植入體是通過收集患者需要替換部位CT掃描數據進行設計,植入一月后患者關節功能恢復正常(圖8(b))。
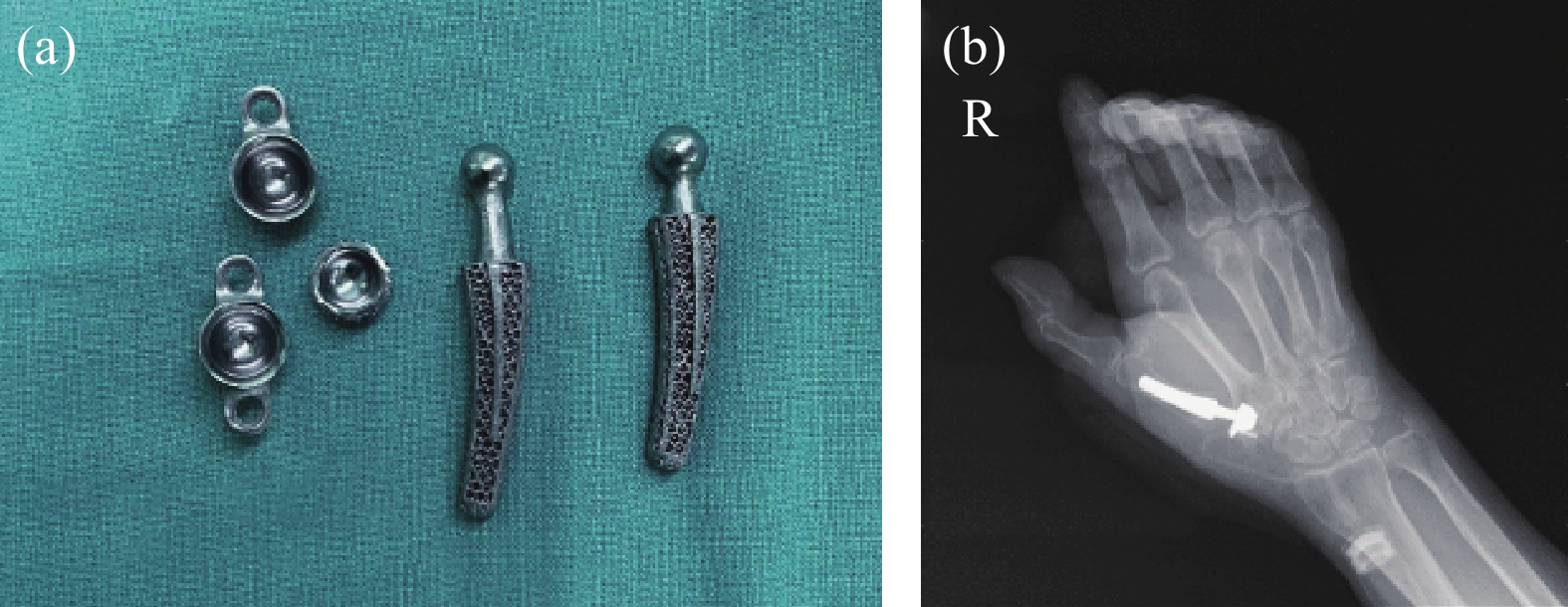
圖8 3D打印鉭金屬腕骨關節:(a)打印成品;(b)植入人體后X光照片[23]
2022年,大連大學附屬中山醫院為患者進行了世界首例3D打印鉭金屬踝關節植入(圖9)[24]。患者踝關節距骨壞死并患有踝關節炎癥,為了解決患者疼痛癥狀并恢復腳踝靈活性,該院為患者個性化定制了3D打印金屬鉭踝關節。植入后患者恢復良好,術后一天即可緩慢行走。 
圖9 3D打印鉭金屬踝關節[24]
骨盆部位手術一直是骨科手術中的難題之一。2022年,大連大學附屬中山醫院為骨盆腫瘤導致右髖關節變形的患者進行了3D打印鉭半骨盆及髖關節假體植入(圖10(a)),進一步拓寬了3D打印多孔鉭的應用[25]。該患者受損部位大,需要切除髂骨、髖臼及部分或全部恥骨和坐骨,切除及植入手術難度高。該院通過3D打印為患者定制的植入體與患者切除后缺損部位高度匹配(圖10(b)),節省了植入手術時間。
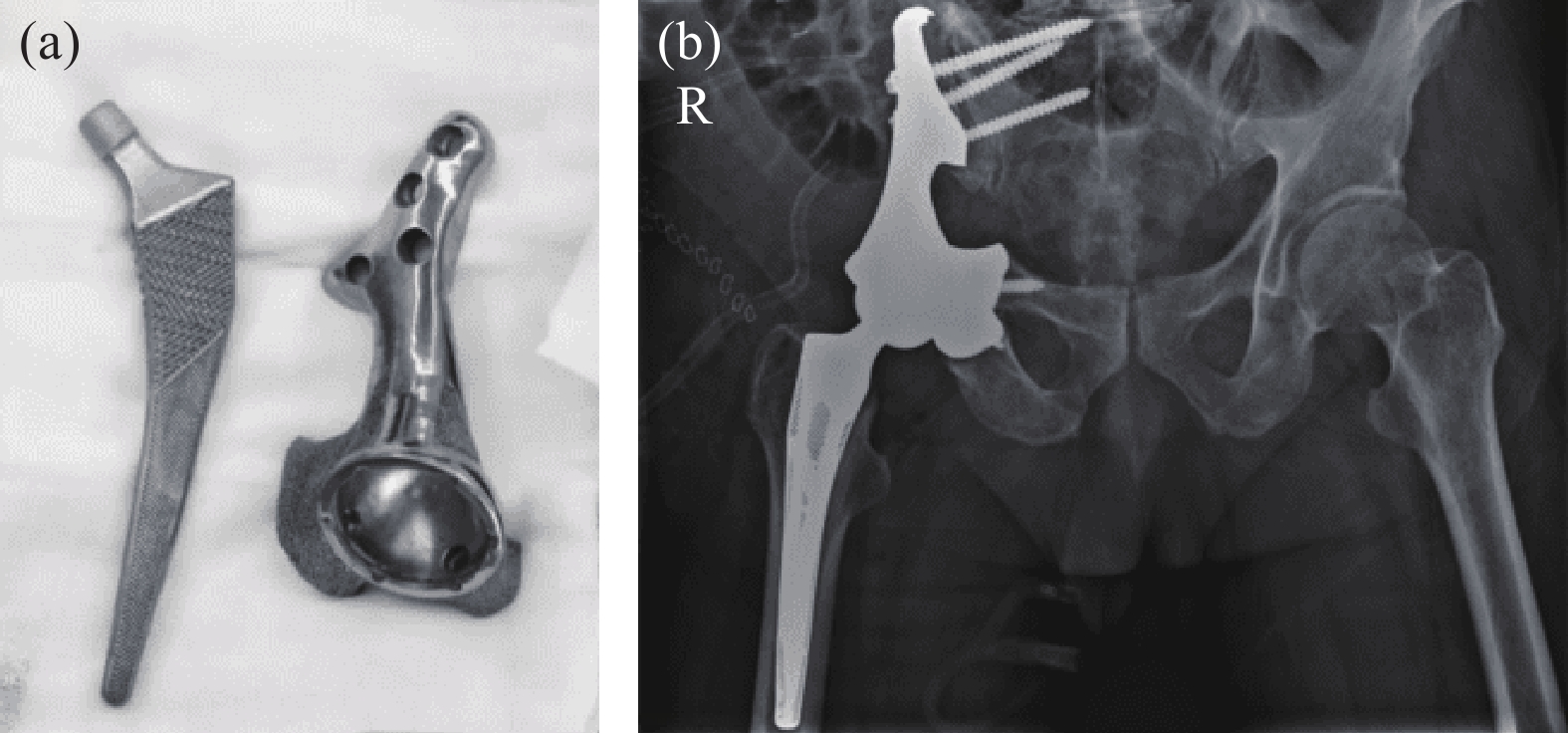
圖10 3D打印鉭金屬骨盆和髖關節:(a)打印成品;(b)植入人體后X光照片[25]
5.3 創傷類產品
2019年4月,由湘雅醫院研發的3D打印小梁結構鉭支架被成功植入股骨壞死的患者體內,這是世界上首例鉭金屬支架植入手術(圖11)[26]。該鉭支架頂端與人體骨接觸處呈弧形,與人體骨弧度相似,受力時支架與人體骨接觸點多,受到壓力較為平均,可防止植入體損壞。

圖11 3D打印鉭金屬支架[26]
6. 結束語
3D打印技術的發展為鉭在醫療領域的應用提供了更廣闊的空間,鉭的應用市場目前正處于快速發展階段。一方面,隨著醫療技術的不斷進步和人口老齡化的加劇,對骨科植入物的需求將不斷增加;另一方面,隨著3D打印技術的不斷發展,打印材料的種類和性能也將不斷增加。
3D打印鉭技術的發展也將面臨一些挑戰。例如,需要進一步提高打印精度和效率,降低成本;需要研究更加先進的打印工藝和材料,以滿足更加復雜和精細的醫療需求;需要加強醫療監管和質量控制,確保3D打印鉭植入物的安全性和有效性。
總體而言,3D打印鉭的市場前景廣闊,但也需要不斷的技術創新和醫療監管來推動其健康發展。
參考文獻:
[1]路榮建,劉洪臣. 多孔鉭作為骨植入材料的研究進展. 中華老年口腔醫學雜志,2013,11(3):173
[2]彭建祥. 鉭的本構關系研究[學位論文]. 四川綿陽: 中國工程物理研究院, 2001
[3]蔡洪楨,賀慧霞. 鉭金屬在臨床應用中的研究進展. 口腔頜面修復學雜志,2017,18(1):46
[4]左更. 我國稀缺性戰略金屬資源保供穩供問題的思考:以鉭、鈮、鉻、鈷為例. 中國國土資源經濟,2023,36(9):4
[5]李秋菊,王丹,周倉,等. 鈮鉭礦酸浸過程中表面微觀結構表征. 有色金屬(冶煉部分),2021(1):61
[6]李浩,王松,余藝平,等. Ta–Hf體系材料研究進展. 中國陶瓷,2020,56(11):10
[7]Di Franco F, Zampardi G, Santamaria M, et al. Characterization of the solid state properties of anodic oxides on magnetron sputtered Ta, Nb and Ta–Nb Alloys. J Electrochem Soc, 2011, 159(1): 33
[8]Traxel K D, Bandyopadhyay A. Modeling and experimental validation of additively manufactured tantalum-titanium bimetallic interfaces. Mater Design, 2021, 207: Art No. 109793
[9]Guo S, Lu Y J, Wu S Q, et al. Preliminary study on the corrosion resistance, antibacterial activity and cytotoxicity of selective-laser-melted Ti6Al4V–xCu alloys. Mat Sci Eng C, 2017, 72: 631 DOI: 10.1016/j.msec.2016.11.126
[10]Chang C, Yan X C, Bolot R, et al. Influence of post-heat treatments on the mechanical properties of CX stainless steel fabricated by selective laser melting. J Mater Sci, 2020, 55: 8303 DOI: 10.1007/s10853-020-04566-x
[11]姜海燕,林衛凱,吳世彪,等. 激光選區熔化技術的應用現狀及發展趨勢. 機械工程與自動化,2019(5):223
[12]楊強,魯中良,黃福享,等. 激光增材制造技術的研究現狀及發展趨勢. 航空制造技術,2016,59(12):26
[13]丁玎. 骨植入體表面鉭基涂層的制備和生物學性能研究[學位論文]. 上海: 中國科學院大學(中國科學院上海硅酸鹽研究所), 2019
[14]Gao H R, Yang J Z, Jin X, et al. Porous tantalum scaffolds: Fabrication, structure, properties, and orthopedic applications. Mater Design, 2021, 210: Art No. 110095
[15]Gao H R, Jin X, Yang J Z, et al. Porous structure and compressive failure mechanism of additively manufactured cubic-lattice tantalum scaffolds. Mater Today Adv, 2021, 12: Art No. 100183
[16]Wang H, Su K X, Su L Z, et al. Comparison of 3D-printed porous tantalum and titanium scaffolds on osteointegration and osteogenesis. Mat Sci Eng C, 2019, 104: Art No. 109908
[17]Wauthle R, Van Der Stok J, Yavari S A, et al. Additively manufactured porous tantalum implants. Acta Biomater, 2015, 14: 217 DOI: 10.1016/j.actbio.2014.12.003
[18]Zhang Y T, Aiyiti W, Du S, et al. Design and mechanical behaviours of a novel tantalum lattice structure fabricated by SLM. Virtual Phys Prototy, 2023, 18(1): Art No. e2192702
[19]高瑞, 陳國景. 用鉭金屬3D打印長節段人工椎體重建脊柱缺損. 西安日報, 2021–07–17(4)
[20]黃文成. 華曙高科助力大洲醫學3D打印多孔鉭椎間融合器實現國產替代進口. 搜狐網湖南. (2023–02–28) [2023–10–06].
[21]楊柳,王富友. 醫學3D打印多孔鉭在骨科的應用. 第三軍醫大學學報,2019,41(19):1859
[22]應嘉蔚. 3D打印多孔鉭假體搭載抗生素為關節感染患者帶來生機!. 大連大學附屬中山醫院. (2022–01–29) [2023–10–06].
[23]Admin. 3D打印多孔鉭金屬掌指關節置換成功實施. 中國3D打印網. (2021–12–14) [2023–10–06].
[24]應嘉蔚, 程亮亮. 醫院成功完成3D打印多孔鉭生物型假體踝關節置換術!. 大連大學附屬中山醫院. (2022–06–29) [2023–10–06].
[25]李東怡. 利用3D打印多孔鉭金屬假體成功治療骨盆巨大惡性腫瘤. 大連大學附屬中山醫院. (2022–06–08) [2023–10–06].
[26]彭放, 王潔. 湘雅專家首創“3D打印+仿生”技術定制鉭金屬多孔支架, 股骨頭壞死早期患者有望終身不換髖關節. 掌上長沙. (2019–04–15) [2023–10–06].
基金項目: 國家重點研發計劃資助項目(2022YFC2406000)
作者簡介:楊振宇(2001—),男,湖北省潛江市人,華南理工大學材料科學與工程學院在讀研究生,主要研究方向為增材制造鉭。通信地址:廣東省廣州市天河區長興路363號廣東省科學院新材料研究所
通訊作者:閆星辰(1990—),男,陜西寶雞人,博士,副研究員,主要研究方向為激光3D打印先進制造。通信地址:廣東省廣州市天河區長興路363號廣東省科學院新材料研究所
來源: 金屬世界


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 金屬世界
金屬世界 