導(dǎo)讀
近日,韓國科學(xué)技術(shù)院(KAIST)Sukbok Chang課題組報(bào)道了一種通用的鐵與手性烯胺雙重催化醛的對映選擇性α-酰胺化反應(yīng)(amidation)(高達(dá)>99:1 er)。基于實(shí)驗(yàn)和計(jì)算研究,作者提出了一種新型的反應(yīng)機(jī)理,其中可見光促進(jìn)LMCT(配體至金屬的電荷轉(zhuǎn)移)生成的[Fe(II)Cl3?]能夠有效地活化二噁唑酮并生成鐵-酰基類氮賓(iron-acylnitrenoid)自由基,其可插入手性烯胺中間體中。文章鏈接DOI:10.1021/jacs.4c07884
(圖片來源:J. Am. Chem. Soc.)
正文
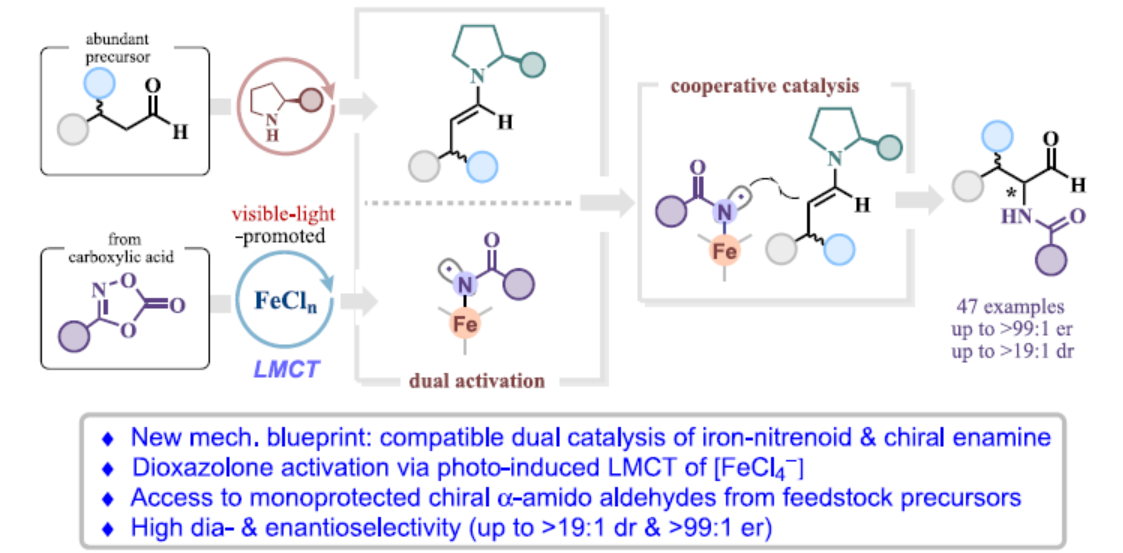
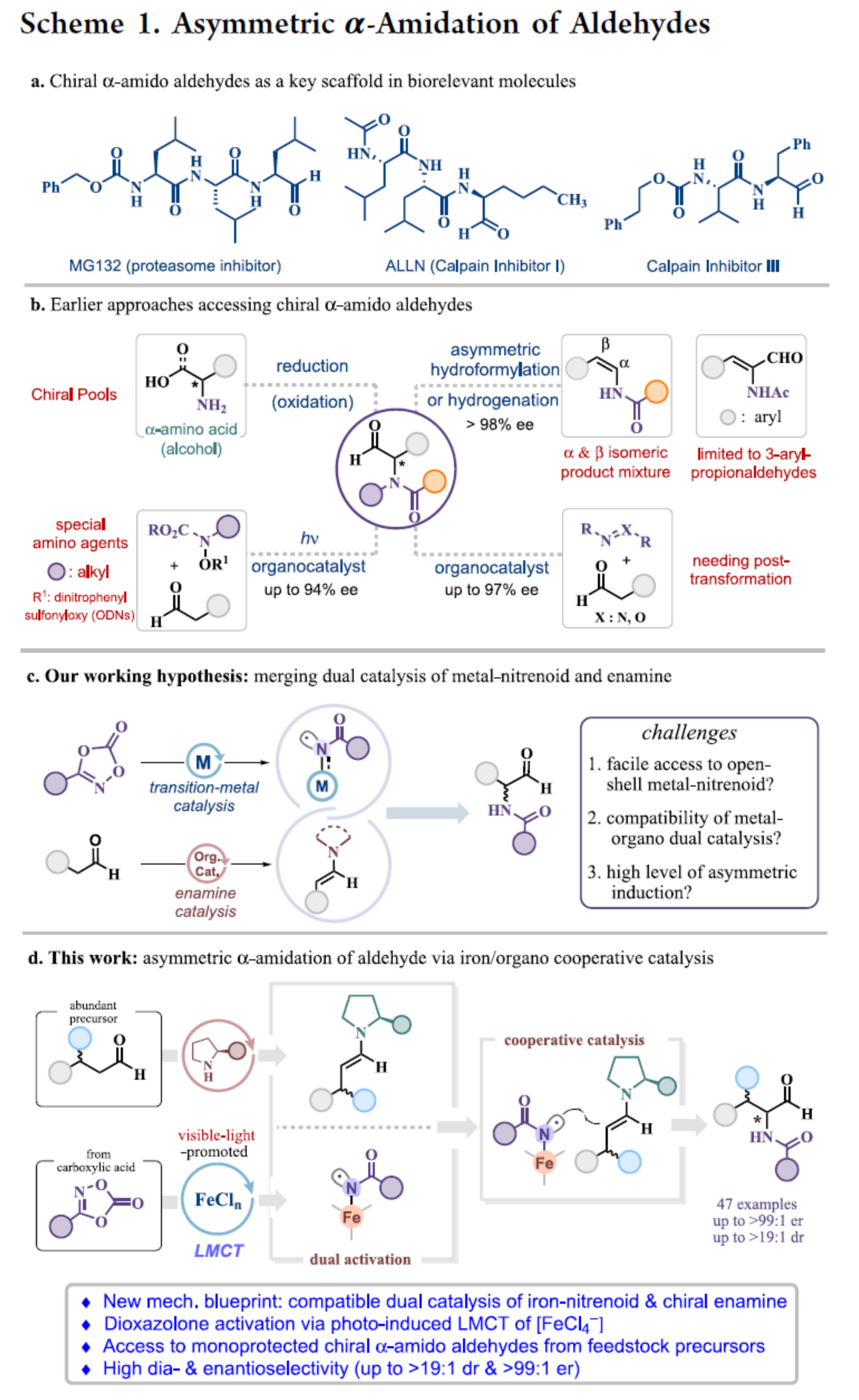
手性α-酰胺醛(amido aldehydes)是一類生物相關(guān)分子的關(guān)鍵結(jié)構(gòu)單元(Scheme 1a)。同時(shí),α-酰胺醛也是合成各種含氨基砌塊的有價(jià)值的前體,包括非天然氨基酸、α-氨基酮或β-氨基醇。目前,化學(xué)家們已開發(fā)幾種合成手性α-酰胺醛的方法(Scheme 1b)。當(dāng)采用α-氨基酸或β-氨基醇作為手性前體時(shí),傳統(tǒng)的還原或氧化方法是有效的。同時(shí),化學(xué)家們還開發(fā)了一些過渡金屬催化的不對稱烯烴轉(zhuǎn)化,如銠催化α-甲酰基烯酰胺氫化和烯酰胺加氫甲酰化反應(yīng)。2002年,List課題組(J. Am. Chem. Soc. 2002, 124, 5656.)和J?rgensen課題組(Angew. Chem. Int. Ed. 2002, 41, 1790.)分別報(bào)道了使用偶氮二羧酸鹽作為氨基源,實(shí)現(xiàn)了脯氨酸催化醛對映選擇性α-胺化的開創(chuàng)性實(shí)例。2013年,MacMillan課題組(J. Am. Chem. Soc. 2013, 135, 11521.)開發(fā)了一種基于有機(jī)催化光氧化還原的方法,可生成與手性烯胺反應(yīng)的N-中心自由基。然而,該過程采用了一種特定的氨基源,其含有光不穩(wěn)定二硝基苯磺酰氧基(ODNs)基團(tuán)。Sukbok Chang課題組假設(shè),金屬催化二噁唑酮的活化可生成開殼金屬-類氮賓化合物,其可與烯胺的反應(yīng)性協(xié)同結(jié)合,從而實(shí)現(xiàn)醛的不對稱α-酰胺化(Scheme 1c)。近日,韓國科學(xué)技術(shù)院Sukbok Chang課題組報(bào)道了一種新型的有機(jī)-鐵雙重催化策略,實(shí)現(xiàn)了可見光促進(jìn)的醛與二噁唑酮的不對稱α-酰胺化反應(yīng),具有優(yōu)異的非對映選擇性和對映選擇性(Scheme 1d)。其中,鐵配合物的配體到金屬電荷轉(zhuǎn)移(LMCT)對于生成類氮賓中間體至關(guān)重要。化學(xué)加——科學(xué)家創(chuàng)業(yè)合伙人,歡迎下載化學(xué)加APP關(guān)注。
(圖片來源:J. Am. Chem. Soc.)
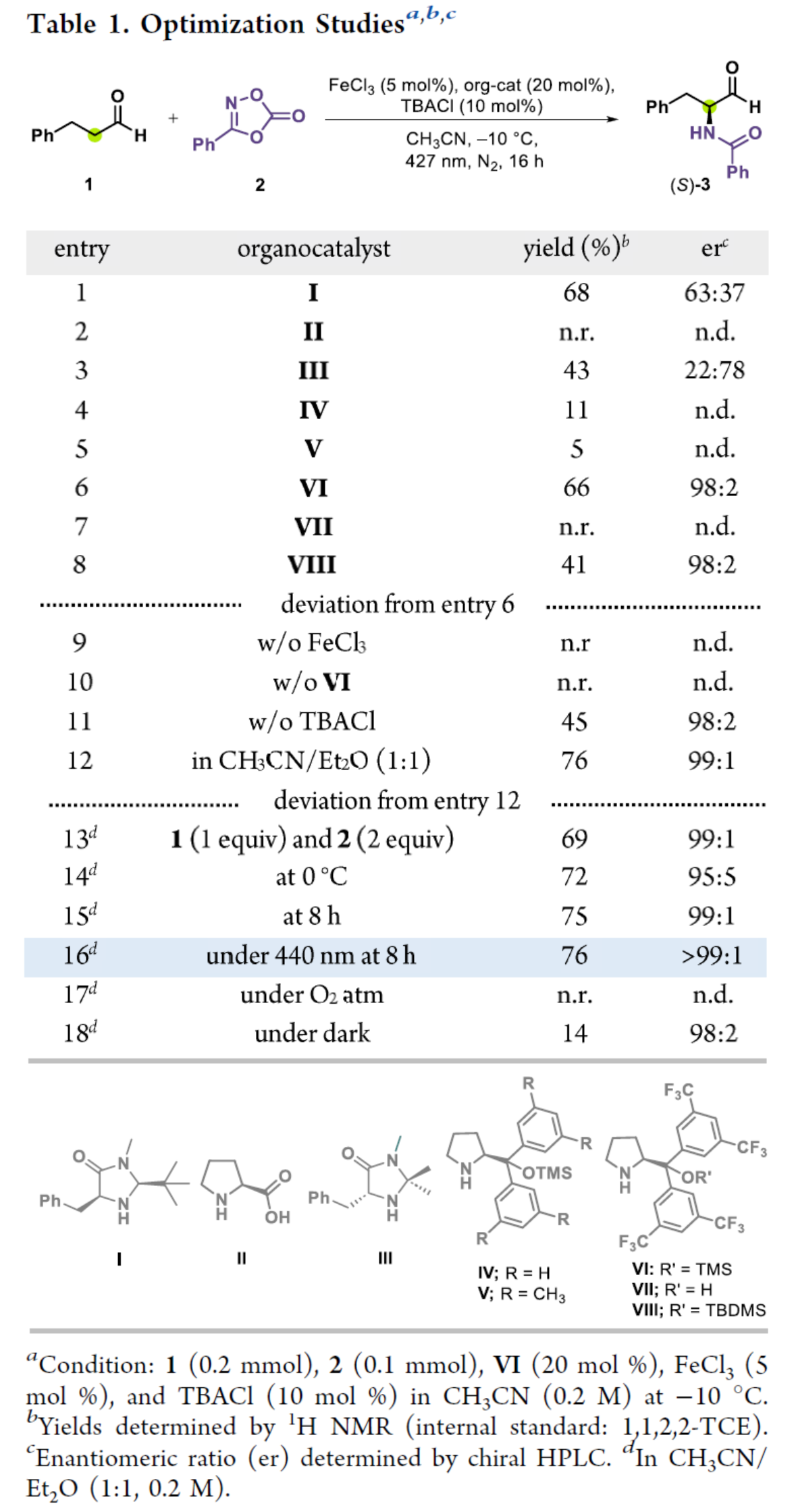
首先,作者以3-苯基丙醛1與3-苯基-1,4,2-二噁唑-5-酮2作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。當(dāng)以(S)-VI(20 mol %)作為有機(jī)催化劑,F(xiàn)eCl3(5 mol %)作為金屬催化劑,TBACl(10 mol %)作為添加劑,440 nm照射下,在CH3CN/Et2O(1:1)混合溶劑中-10 oC反應(yīng)8 h,可以76%的收率得到產(chǎn)物(S)-3,er > 99:1。
(圖片來源:J. Am. Chem. Soc.)
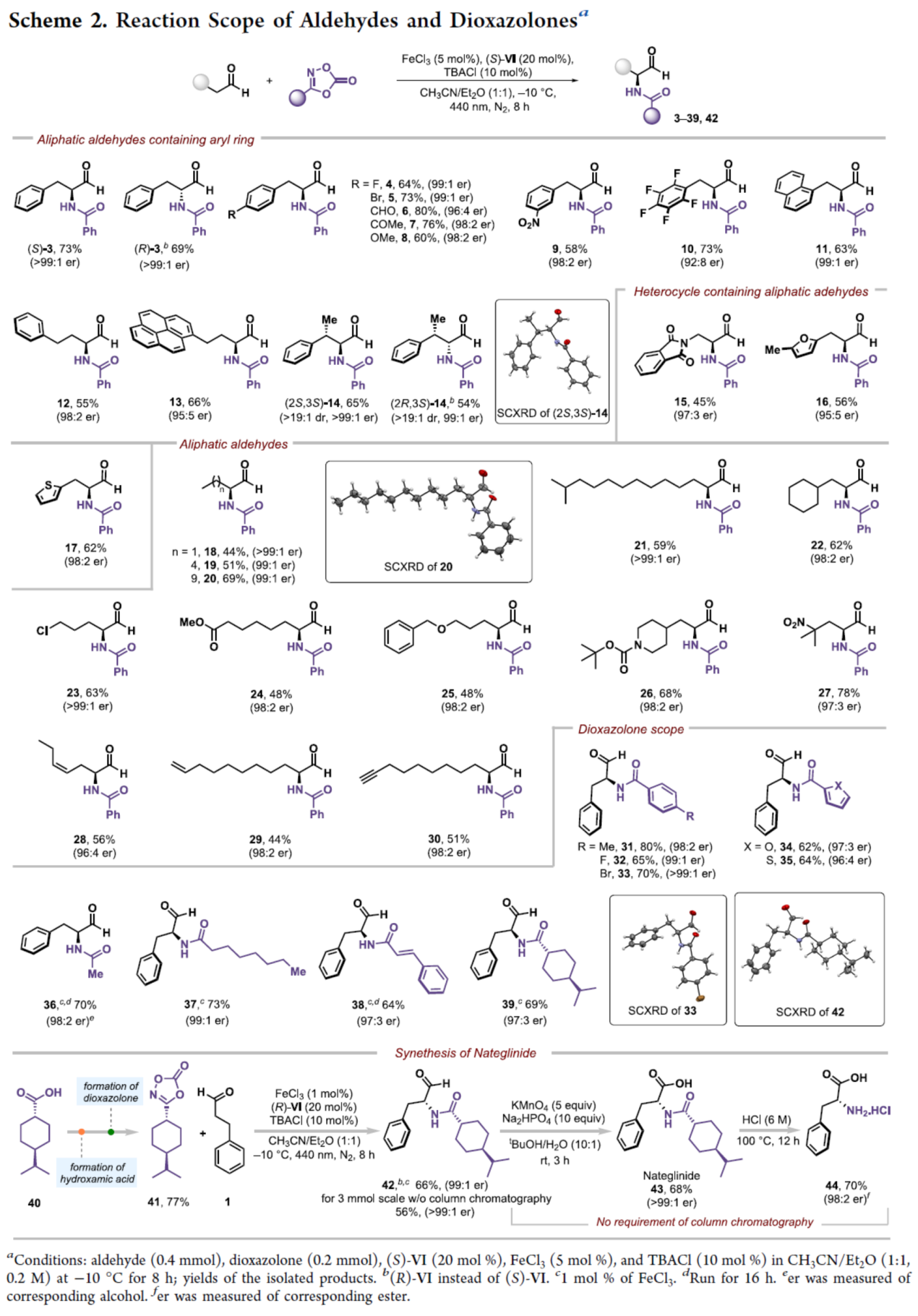
在獲得上述最佳反應(yīng)條件后,作者對醛和二噁唑酮底物范圍進(jìn)行了擴(kuò)展(Scheme 2)。首先,一系列含有不同電性取代的芳基和雜環(huán)取代的脂肪醛,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物3-17,收率為45-80%,er為92:8->99:1。其次,一系列直鏈或支鏈烷基取代的脂肪醛,也是合適的底物,獲得相應(yīng)的產(chǎn)物18-30,收率為44-78%,er為96:4->99:1。此外,一系列(雜)芳基二噁唑酮和烷基取代的二噁唑酮,也能夠順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物31-39,收率為62-80%,er為96:4->99:1。值得注意的是,一系列活性的基團(tuán)(如鹵素、烷氧羰基、甲酰基、烯基、炔基等)均與體系兼容,進(jìn)一步證明了反應(yīng)具有出色的官能團(tuán)兼容性。同時(shí),以化合物41和1為底物,在上述的標(biāo)準(zhǔn)條件以及隨后的氧化條件下,可以兩步44%的總收率得到那格列奈(Nateglinide,43),這是一種治療糖尿病的藥物。然后,通過進(jìn)一步的脫保護(hù)后,43可轉(zhuǎn)化為氨基酸D-苯丙氨酸(44),收率為70%,er為98:2。值得注意的是,該過程無需進(jìn)行色譜的分離。
(圖片來源:J. Am. Chem. Soc.)
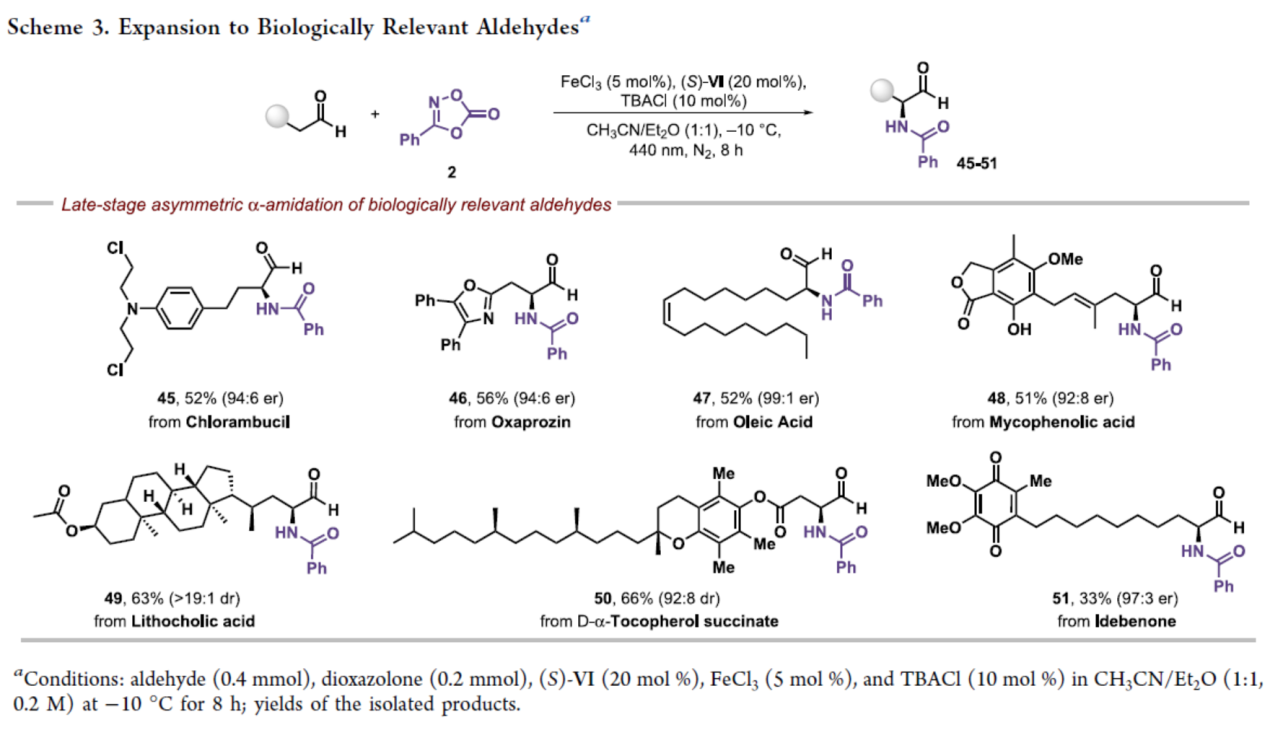
緊接著,該策略還可用于一些生物相關(guān)分子的后期衍生化,如苯丁酸氮芥(Chlorambucil)、奧沙普秦(Oxaprozin)、油酸(Oleic acid)、麥考酚酸(Mycophenolic acid)、石膽酸(Lithocholic acid)、D-α-生育酚琥珀酸酯(D-α-Tocopherol succinate)和艾地苯醌(Idebenone),獲得相應(yīng)的衍生物45-51,收率為33-63%,er為92:8-99:1(Scheme 3)。
(圖片來源:J. Am. Chem. Soc.)
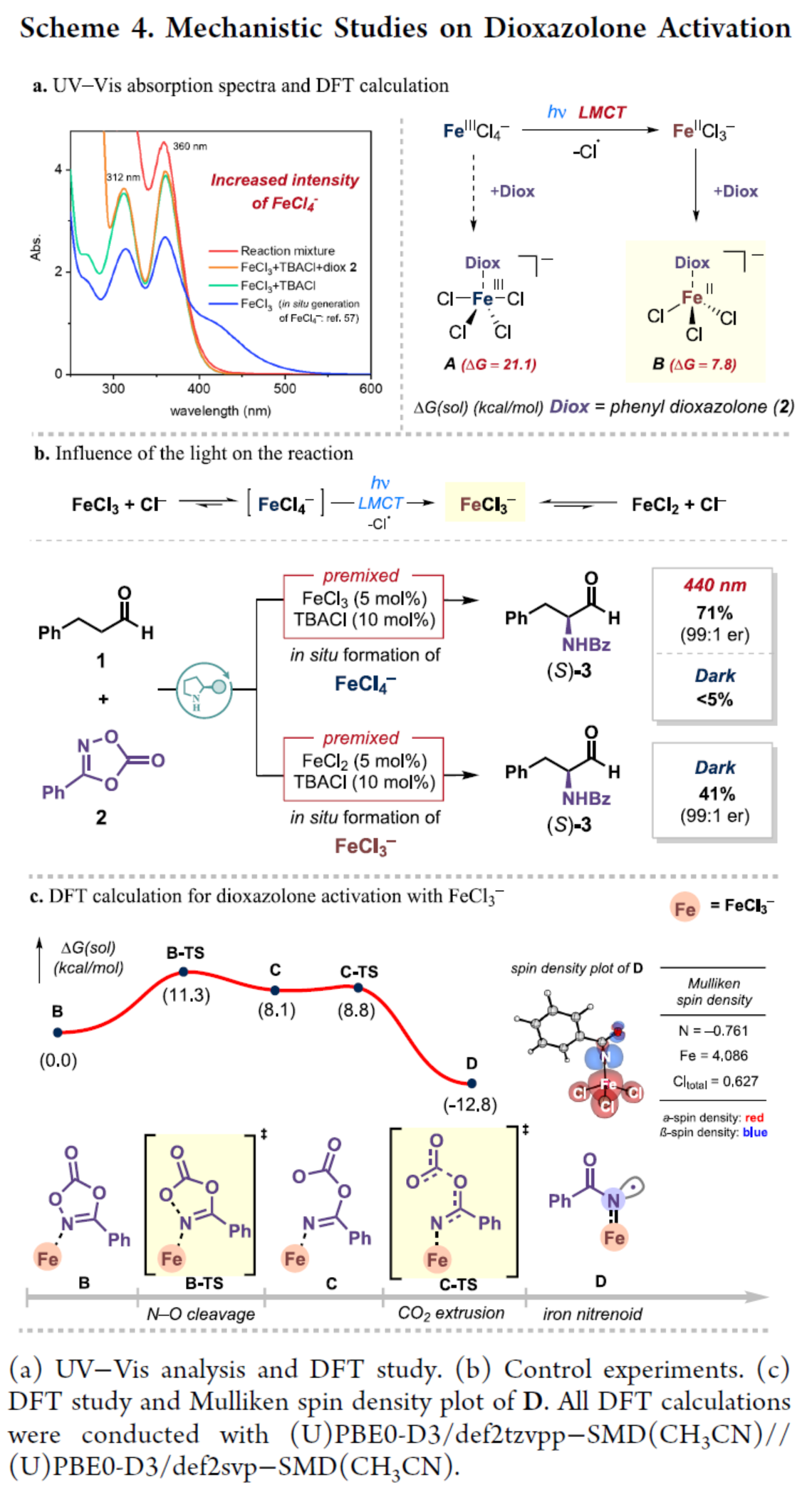
此外,作者還對反應(yīng)機(jī)理進(jìn)行了進(jìn)一步的研究(Scheme 4)。首先,UV-Vis結(jié)果發(fā)現(xiàn),F(xiàn)eCl3溶液在312 nm和360 nm附近顯示出特征峰,對應(yīng)于FeCl4?,可能是由FeCl3前體通過與CH3CN中FeCl2+的平衡產(chǎn)生的。添加TBACl添加劑后,無論是否存在二噁唑酮2,F(xiàn)eCl4?的這些峰的強(qiáng)度都會(huì)增加(Scheme 4a)。DFT研究結(jié)果表明,盡管FeCl4?是在標(biāo)準(zhǔn)條件下原位形成的,但FeCl4?與二噁唑啉酮的直接結(jié)合導(dǎo)致其活化是具有挑戰(zhàn)性的。或者,F(xiàn)eCl4?的LMCT在光照下會(huì)產(chǎn)生FeCl3?,并且該物種將在結(jié)合時(shí)負(fù)責(zé)二噁唑酮的活化。控制實(shí)驗(yàn)結(jié)果表明,F(xiàn)eCl3?是通過FeCl4?的LMCT形成的,在上述的反應(yīng)條件下,F(xiàn)eCl3?主要活化二噁唑酮(Scheme 4b)。進(jìn)一步的DFT計(jì)算結(jié)果表明,二噁唑酮2中的N?O鍵斷裂非常容易被FeCl3?破壞,隨后釋放CO2也很容易。生成的鐵-類氮賓D是放熱的。同時(shí),鐵-類氮賓D是高自旋的Fe(III)-亞氨基自由基(Scheme 4c)。
(圖片來源:J. Am. Chem. Soc.)
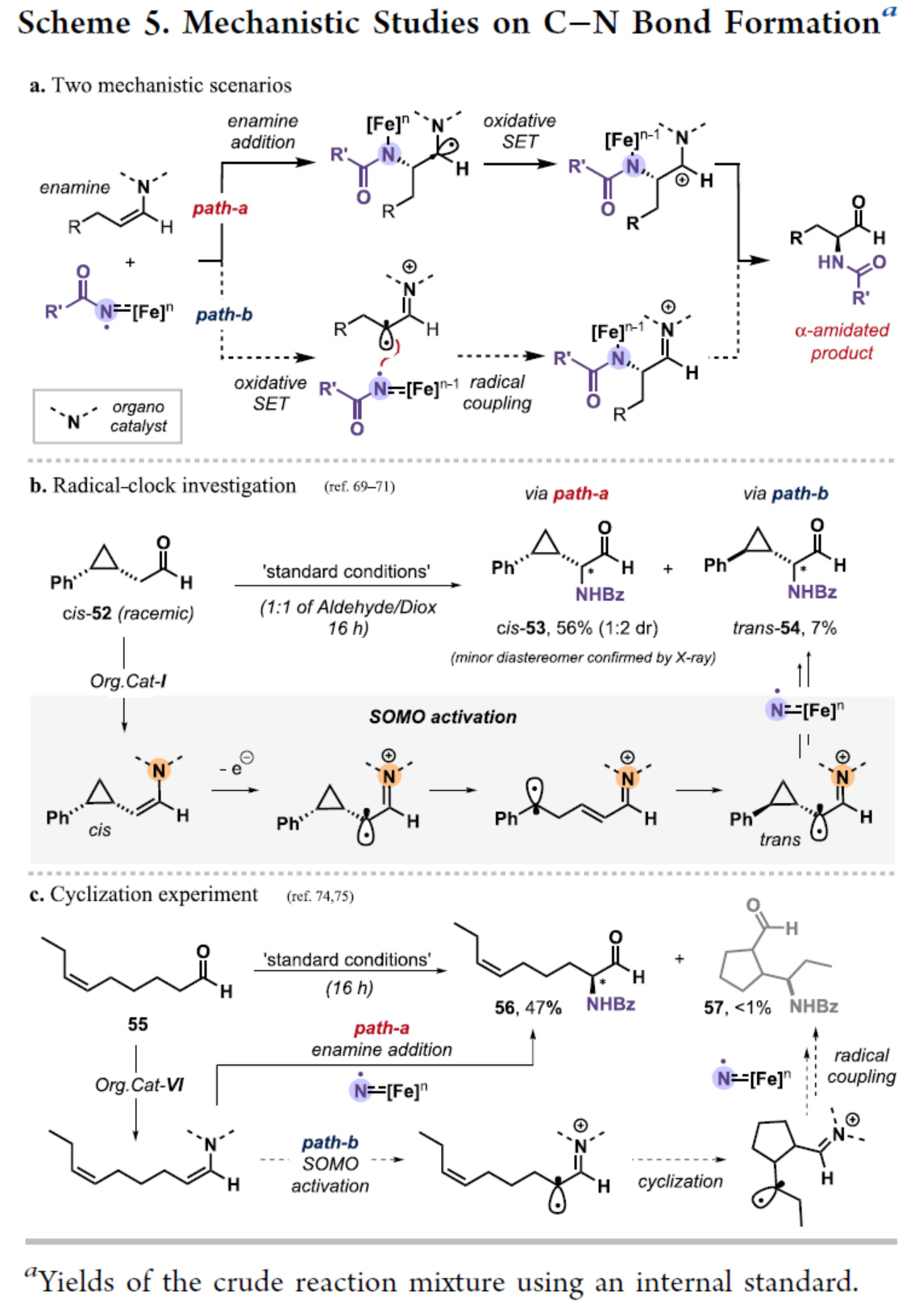
基于上述的研究以及相關(guān)文獻(xiàn)的查閱,作者提出了兩種合理C-N鍵的形成的過程(Scheme 5)。在Path a中,烯胺加成到亞胺基(imidyl)自由基上,然后進(jìn)行氧化1e轉(zhuǎn)移(SET)。在Path b中,烯胺的氧化SET,稱為單占據(jù)分子軌道(SOMO)活化,以及亞胺基自由基和碳自由基(carboradical)之間的自由基偶聯(lián)(Scheme 5a)。同時(shí),相關(guān)的自由基鐘實(shí)驗(yàn)結(jié)果表明,雖然C-N形成的兩種途徑都是合理的,但烯胺直接加成到亞胺基(imidyl)自由基的過程更占主導(dǎo)地位(Scheme 5b)。其次,環(huán)化對照實(shí)驗(yàn)結(jié)果也進(jìn)一步支持了烯胺加成途徑更為合理,但也不能完全排除SOMO過程(Scheme 5c)。
(圖片來源:J. Am. Chem. Soc.)
總結(jié)
韓國科學(xué)技術(shù)院Sukbok Chang課題組報(bào)道了一種鐵與有機(jī)小分子雙重催化醛的對映選擇性α-酰胺化反應(yīng)(高達(dá)>99:1 er)。機(jī)理研究表明,通過可見光促進(jìn)的LMCT原位生成的[Fe(II)Cl3?]能夠有效地活化二噁唑酮,并生成了鐵-酰基類氮賓自由基,隨后插入手性烯胺中間體。鑒于其出色的不對稱誘導(dǎo)作用,這種方便的醛不對稱α-酰胺化反應(yīng)將具有廣泛的合成應(yīng)用。
來源: 化學(xué)加


 科普中國公眾號(hào)
科普中國公眾號(hào)
 科普中國微博
科普中國微博

 幫助
幫助
 化學(xué)加
化學(xué)加 
