根據國家衛生健康委員會發布的《卵巢癌診療指南(2022 版)》,我國卵巢癌年發病率居女性生殖系統腫瘤第 3 位,僅次于子宮頸癌和子宮體惡性腫瘤,病死率位于女性生殖道惡性腫瘤之首,其 5 年生存率與診斷時的病程階段密切相關。根據美國國家癌癥研究所發布的數據,在早期的局部感染階段,卵巢癌 5 年生存率為 92.4% ,而轉移階段 5 年存活率則下降至 31.5%。
卵巢深處盆腔,卵巢病變處于早期時常無特異臨床癥狀,因出現癥狀就診時,70% 的患者已處于晚期。因此卵巢癌的早期診斷具有重大意義。
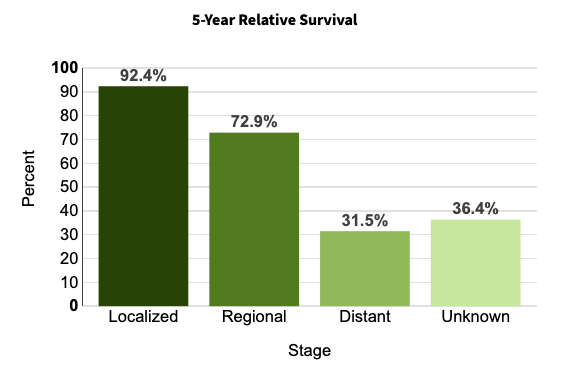
卵巢癌不同階段的 5 年生存率
近日,中山大學腫瘤防治中心婦科劉繼紅教授團隊,聯合南方醫科大學、華中科技大學同濟醫學院附屬同濟醫院、浙江大學醫學院附屬婦產科醫院,針對卵巢癌目前早期診斷困難、缺乏有效腫瘤標志物的困境,構建了卵巢癌診斷人工智能融合模型 MCF,輸入常規實驗室檢驗數據和年齡即可計算卵巢癌的患病風險。相關成果已發表于《柳葉刀·數字健康》(The Lancet Digital Health)。

研究亮點:
* 該研究收集了我國 3 家醫院的數據,并使用基于多標準決策的分類融合 (MCF) 框架來開發模型
* 該模型識別卵巢癌的準確率優于 CA125 和 HE4 等傳統生物標志物
* 該研究證明了低成本、易獲得的常規實驗室檢測,具備成為有效卵巢癌診斷工具的潛力
匯集 3 家醫院、1 萬名患者、98 項相關檢查及數據
研究人員收集了 2012 年 1 月 1 日至 2021 年 4 月 4 日期間,中山大學腫瘤防治中心、華中科技大學同濟醫學院附屬同濟醫院、浙江大學醫學院附屬婦產科醫院內,超過 1 萬例患者(卵巢癌及子宮附件良性病變/正常體檢女性患者)的 98 項實驗室檢查和臨床特征數據。
其中,華中科技大學同濟醫學院參與者(共 3,007 人)的數據被選為訓練集,并在該訓練集上進行了五倍交叉驗證。兩個外部驗證集分別來自浙江大學醫學院婦女醫院(共 5,641 人)和中山大學腫瘤中心(共 2,344 人)。
MCF:融合 20 個基礎分類模型
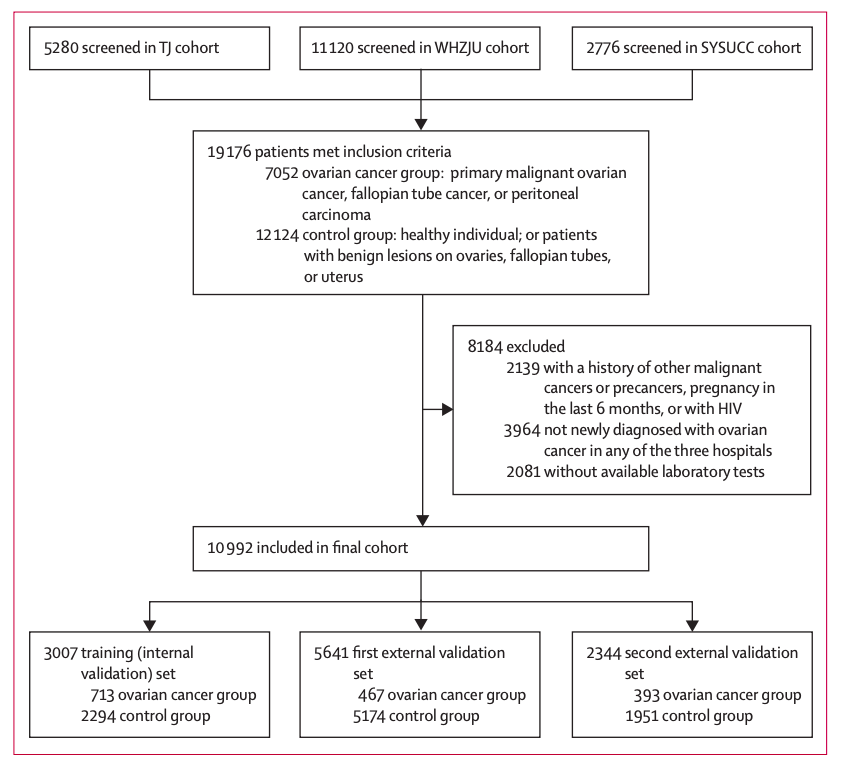
研究流程圖
該研究招募了我國 3 個不同地區的大量參與者。3 個隊列中卵巢癌診斷的中位年齡為 51-56 歲。然而,大規模數據也帶來了一些問題。例如,多中心數據是異質的,不利于構建穩健的人工智能模型,并且存在一些缺陷,包括卵巢癌患者和對照參與者數量之間存在顯著不平衡,單位不一致,以及大量的缺失值(內部驗證集為 48.5%)。
為了解決這些數據問題,確保模型的穩健性,研究人員進行了大量的數據清洗工作,包括:
* 構建模型時,將 98 項實驗室檢測項目列為候選輸入特征。對于單位不同的實驗室檢測項目,進行了單位統一處理。
* 缺失數據通過 MICE (multivariate imputation by chained equations) 算法進行估算。
* 為了減少機構間數據分布的差異,使用 Box-Cox 算法進行了數據調和,然后通過 min-max 標準化進行了數據規范化處理。
* 為了解決數據不平衡問題,采用了自適應綜合采樣方法,平衡比例為 0.5。
此外,MCF 框架是該研究團隊在先前工作中提出的 H-MCF(基于 MCF 的分層預測方案)的一個變體,研究人員建立了 176 個基礎分類模型,并結合了特征選擇方法 (feature selection method) 與機器學習分類器 (machine-learning classifier),通過五倍交叉驗證,從 176 個模型中選出前 20 個基礎分類模型。其中 ,特征選擇過程將識別最重要的 20 個特征,供分類器使用以生成一個基礎分類模型。
隨后,研究人員根據多準則決策理論 (multi-criterion decision-making) 估計每個模型的權重,最終融合其預測以達成一致性分類。
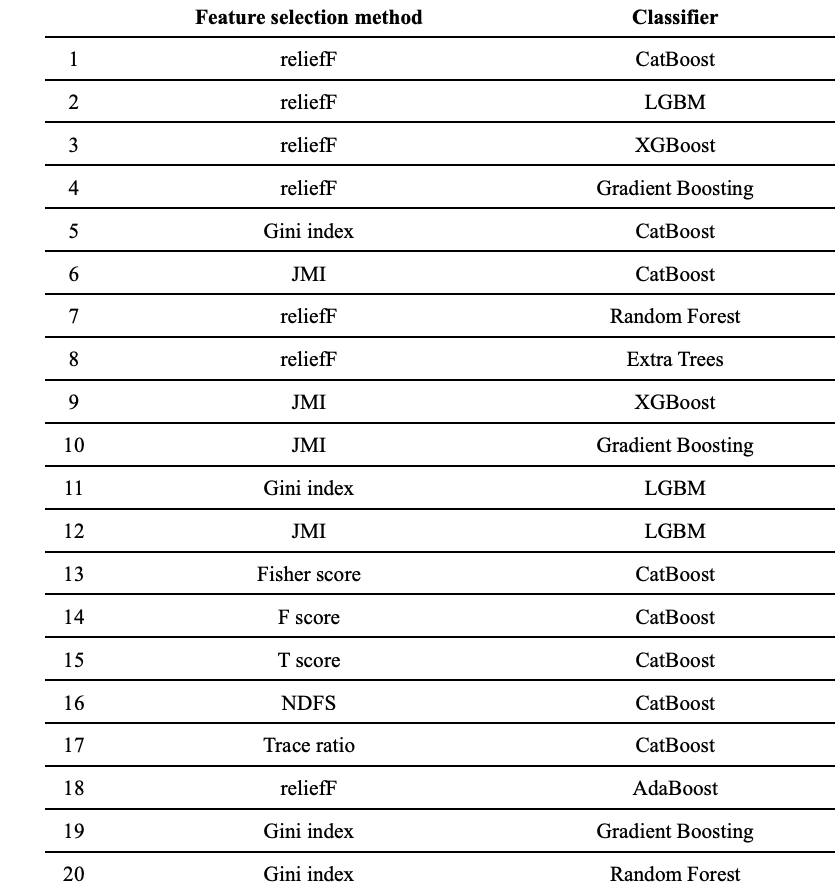
前 20 個基礎分類模型
模型性能顯著高于傳統方法
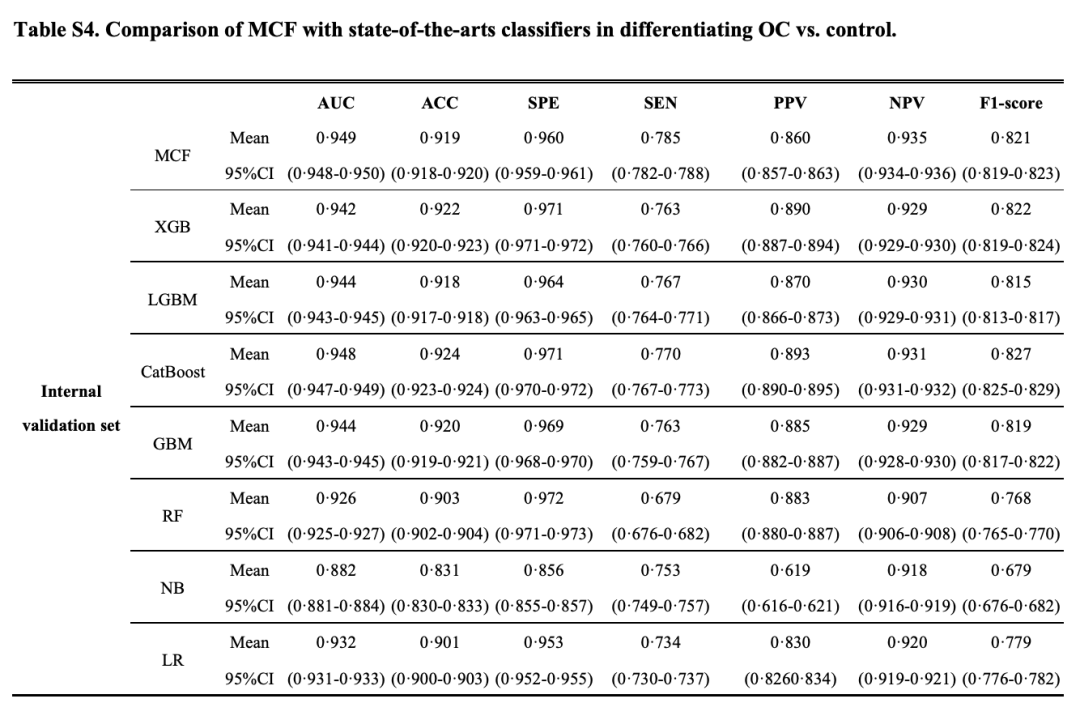
研究人員通過 AUC、準確性、特異性、敏感性、陽性預測值、陰性預測值和 F1 分數,來量化 MCF 模型預測準確性,結果如下圖所示:
研究人員從前 20 個基礎分類模型中選出的 52 個特征(51 項實驗室檢驗指標和年齡),其中約 90% 的特征與卵巢癌的風險顯著相關,并基于 SHAP(Shapley Additiveexplanation ,一種評估和解釋模型預測的技術)構建了類似的一致性特征排名。單個特征的預測 AUC 范圍為 0.477 (AFP) 至 0.886 (CA125),并且總體上與它們的排名一致。
其中,51 項實驗室檢驗指標包含了常規血液檢查、尿檢、生化檢查等,例如血小板 PLT、纖維蛋白原測定 FIB、評定炎癥程度的指標 CRP、測定血清白蛋白水平的 ALB、紅細胞沉降率 ESR、尿 ph 值等。下圖 A 為檢驗指標的重要性排序。
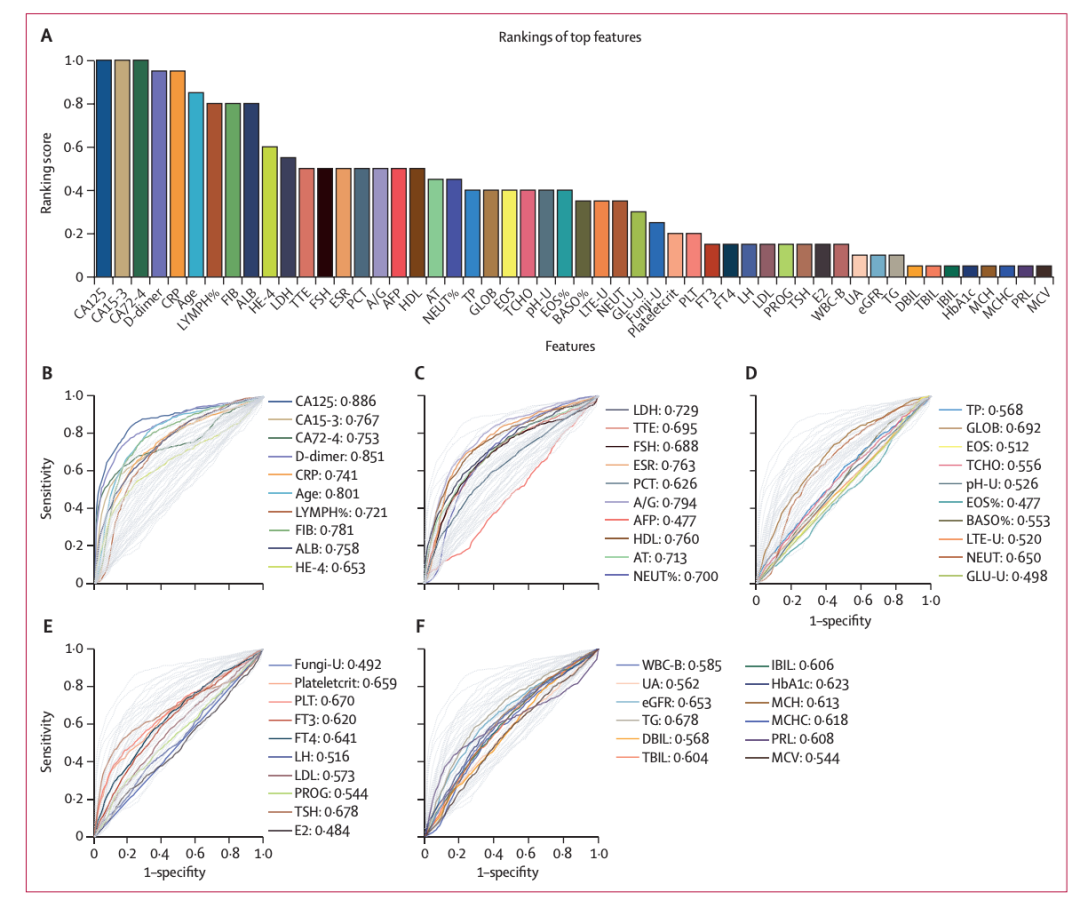
特征排名及相關分析
MCF 在內部驗證集和兩個獨立的外部驗證集上的 AUC 分別達 0.949 (95%CI 0.948-0.950)、0.882 (0.880-0.885) 和 0.884 (0.882-0.887)。
研究人員還將 MCF 與卵巢癌檢測中的傳統腫瘤標志物進行了比較。對于區分卵巢癌的所有 3 個驗證集,MCF 的 AUC、敏感性和 F1 評分均高于傳統腫瘤標志物,如下圖所示:
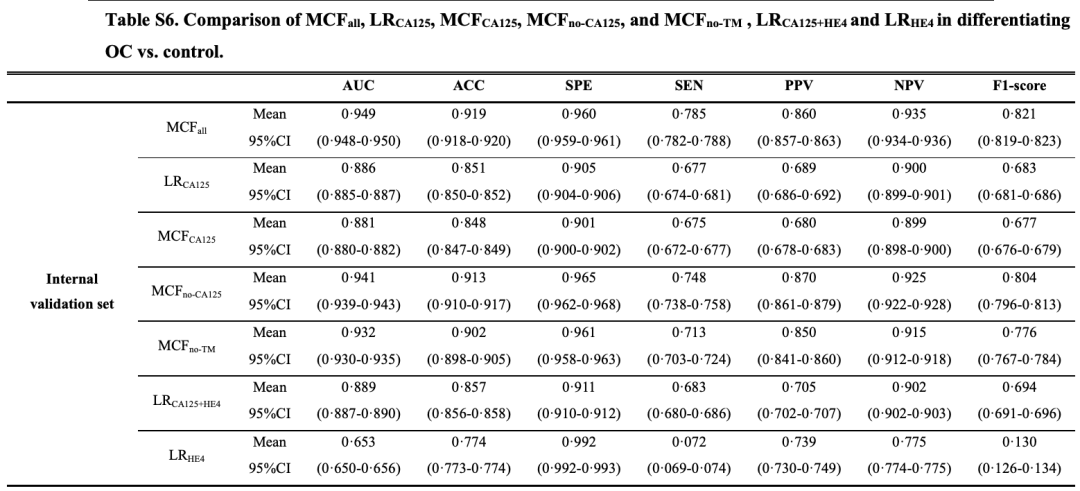
對于晚期卵巢癌與對照組的分類,MCF 在內部驗證集中的 AUC 為 0.985;第一個外部驗證集達到 0.972,第二個外部驗證集達到 0.943。對于早期卵巢癌癥與對照組的分類,MCF 在內部驗證集中的 AUC 為 0.879,在第一和第二外部驗證集中分別為 0.823 和 0.810。
研究結果顯示,MCF 模型識別卵巢癌患者、特別是早期卵巢癌患者的 AUC 和靈敏度顯著高于傳統卵巢癌標志物 CA125、HE4 及兩者聯合,且在部分指標缺失的人群中依然可以對卵巢癌的風險進行較準確的預測,這表明 MCF 模型具有較好的穩定性,并對真實世界數據具有較好的兼容性。
此外,本研究還發現,除腫瘤標志物外,其他常規實驗室檢驗,如 D-D二聚體、血小板計數等,也對卵巢癌診斷預測有較大貢獻,提示這些檢驗指標相關病理生理過程可能在卵巢癌的發展過程中發揮了重要作用,其潛在機制值得進一步探討。
AI 賦能基層醫療發展
根據「2022 年我國衛生健康事業發展統計公報」,盡管我國基層醫療衛生機構達到 979,768 個,占全國醫療衛生機構總數的 94.85%,但就診療量而言,基層醫療衛生機構診療量 42.7 億人次,僅占全年總診療量的 50.7%。可以看出,我國基層醫療衛生機構數量占比較高,但診療量仍有較大上升空間。
此外據國家癌癥中心的數據統計,在我國腫瘤醫療服務市場,公立三甲醫院承擔了超過 80% 的腫瘤治療任務。這些三甲醫院大多分布在省會城市,卻要同時接待來自四面八方的患者,醫生的壓力可想而知。
但近些年人工智能的成熟應用給醫療行業帶來了無限遐想,也為基層就診提供了新思路。本研究構建的卵巢癌診斷模型 MCF 已開源,輸入相應實驗室檢驗數據和年齡即可計算患卵巢癌的風險值,無疑為該模型在基層醫療機構的普及提供了重要助力。
人工智能輔助診斷在基層衛生機構的配置至關重要,國務院此前印發的「關于進一步深化改革促進鄉村醫療衛生體系健康發展的意見」中也提到,要加快推動人工智能輔助診斷在鄉村醫療衛生機構的配置應用。
人工智能應用于基層衛生機構,不僅可以將醫療信息處理為結構化數據,解決「數據孤島」和數據質量問題,為區域內的醫療信息互聯共享打下基礎;還能通過輔助問診、輔助診斷、慢病管理等功能,提高基層診療水平,降低漏診、誤診概率,讓更多地方享受到高質量的診斷和治療。
參考資料:
1.https://www.sysu.edu.cn/news/info/2331/1091611.htm
來源: HyperAI超神經


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 HyperAI超神經
HyperAI超神經 
