DME(糖尿病性黃斑水腫)是糖尿病的一種持續并發癥,其特征是視網膜神經血管單位的退行性變。“糖尿病不可怕,可怕的是并發癥”——糖尿病性黃斑水腫影響著4%的糖尿病患者,仍然是導致全球人口失明的主要原因之一 [1]。視網膜有精細的血管化,以維持升高的視網膜視覺所需求的能量,因此神經視網膜及其血管特別容易受到代謝紊亂的影響,如糖尿病視網膜病變(DR)。值得注意的是:在糖尿病視網膜病變的不同階段,血-視網膜屏障(BRB)的破裂導致糖尿病性黃斑水腫,其中血漿外滲和循環蛋白進入視網膜內和視網膜下間隙會導致腫脹和隨后的視力喪失。
現有療法的分析及新療法開發的必要性
糖尿病性黃斑水腫是糖尿病最常見的影響視力并發癥,目前主要包括2類療法:1:系統治療:控制高血糖和高血壓;2: 局部治療:抗血管內皮細胞生長因子(VEGF)抗體,糖皮質激素(玻璃體內注射)和激光。現有療法的僅對大約一半的糖尿病患者有效,且需要頻繁注射于眼部,同時存在各種副作用[2] (圖1)。目前迫切需要更有效的的新療法。

圖1:糖尿病性黃斑水腫現有療法的對比分析
近日,來自加拿大蒙特利爾大學-羅斯蒙特醫院研究中心、美國Unity Biotechnology的研究人員在Nature Medicine期刊上發表了題為Therapeutic targeting of cellular senescence in diabetic macular edema: preclinical and phase 1 trial results 的最新成果。文章提出了針對糖尿病性黃斑水腫的抑制細胞衰老機制并評估了一種抗衰老藥物UBX1325。其數據顯示UBX1325通過抑制抗凋亡的B細胞淋巴瘤-2(BCL-2)家族成員BCL-xL,特異性靶向衰老細胞——注射一針,療效可至少持續半年——對抗VEGF療法難治的糖尿病性黃斑水腫患者的視力和黃斑厚度具有有益和長效的改善作用。
抗衰老治療(UBX1325)的理論依據
糖尿病對視網膜造成多種代謝應激,包括高血糖、循環和組織氨基酸和脂質濃度的改變,以及繼發性神經炎癥,導致視網膜神經血管單元的破壞[3]。這些應激導致內質網應激、自噬和誘導細胞死亡途徑,如細胞凋亡、焦亡和鐵死亡。雖然糖尿病視網膜病變是多因素起源的,但與糖尿病性黃斑水腫中血管功能障礙相一致的潛在統一的病理機制可能為細胞衰老。已經進入衰老狀態的細胞仍然具有生存活性和代謝活性,產生廣泛的炎癥因子和分泌金屬蛋白酶,這種狀態被稱為與衰老相關的分泌表型(SASP)并改變近端細胞環境和細胞外基質[4][5]。中樞神經系統內的衰老內皮細胞(ECs)失去了細胞連接的完整性和血-視網膜屏障的破裂。有證據表明,衰老細胞在糖尿病視網膜中;積累更具體地說,是在糖尿病視網膜中積累[6][7]。
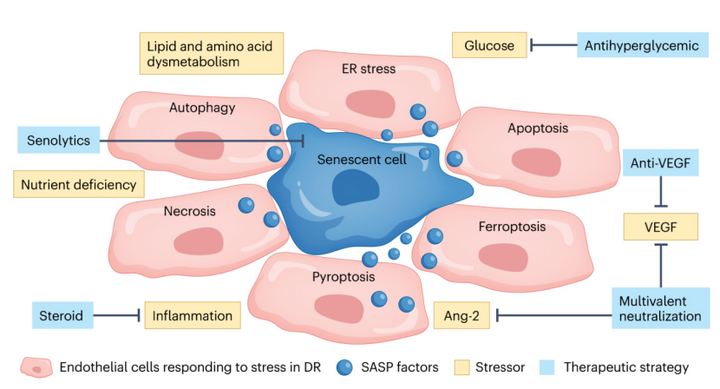
圖2衰老治療作為糖尿病黃斑水腫的一種新選擇。在多種機制中,衰老細胞失去細胞間連接,同時增加細胞旁通量,進一步促進血管生長鄰近細胞的通透性,由SASP介導。衰老療法恢復了血-視網膜屏障,而其他療法針對各種細胞應激源。DR:糖尿病視網膜病變;ER:內質網。
UBX1325測試成果
基于現有的機制理論,Crespo-Garcia等人首先通過分析人供體視網膜和玻璃體、胰島素缺陷小鼠和人視網膜內皮細胞,建立了糖尿病性黃斑水腫病理生理學中衰老的生化、生理和病理證據。他們證實了先前關于糖尿病患者玻璃體中細胞因子水平升高的發現。
進一步探究中,作者為了識別在糖尿病患者中衰老的視網膜細胞群,對來自糖尿病小鼠的單細胞進行單細胞測序RNA-seq,數據顯示最受干擾的細胞群是視錐光感受器、Müller膠質細胞和內皮細胞(圖3)。
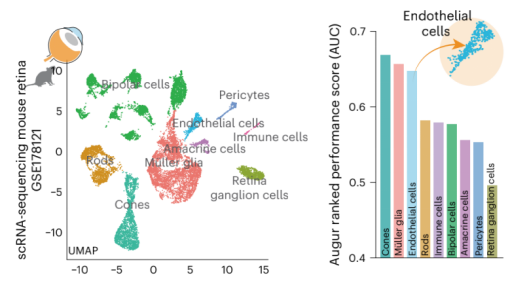
圖3:單細胞測序識別糖尿病患者中衰老的視網膜細胞群
如上所述,糖尿病可誘導視網膜內皮細胞的衰老,且持續的高血糖將驅動內皮細胞的衰老;已有文獻報道BCL-2家族蛋白對衰老細胞的存活至關重要,并且可以通過細胞凋亡來靶向清除衰老細胞[8]。為了確定靶向BCL-xL是否能改善糖尿病小鼠視網膜的屏障功能,作者在視網膜病變小鼠玻璃體內注射UBX1325(一種具有抗衰老特性的小分子BCL-xL抑制劑),數據顯示可減少Caspase的活性;在糖尿病變小鼠玻璃體內注射UBX1325,數據顯示降低視網膜血管的通透性(圖4)。
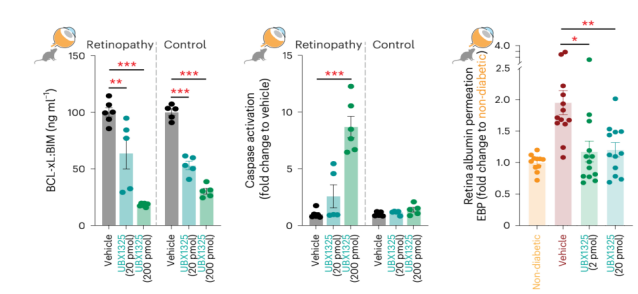
圖4: UBX1325能改善糖尿病小鼠視網膜的屏障功能
最鼓舞人心的是:在一項臨床1期研究中,入組抗-VEGF治療糖尿病性黃斑水腫無效的8名患者,單次玻璃體內注射UBX1325后,視網膜功能得到改善;黃斑厚度也下降(圖5)。
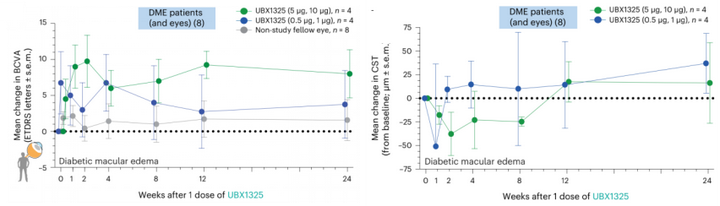
圖5: UBX1325的臨床1期數據
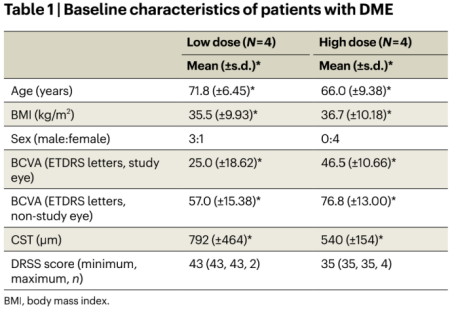
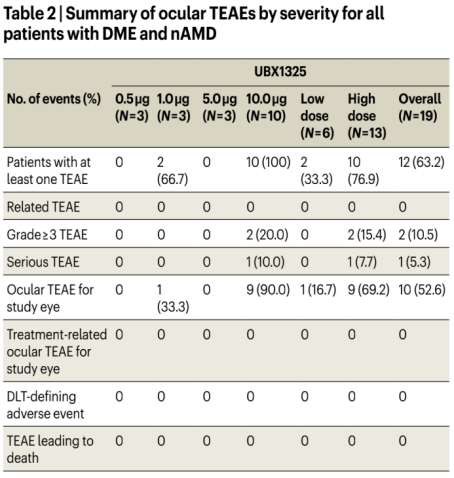
目前的一期臨床數據未發現與UBX1325相關的嚴重眼部或全身性不良事件(Table1,2)。但有一點需特別注意:雖UBX1325沒有安全性問題的報道,但這是一項短期研究,該藥物的安全性值得進一步評估。
綜上所述:作者最新發表的文章內,通過多種模型及技術對“清除衰老細胞以改善與衰老相關的疾病”的概念完成了進一步的探究,并提供了支持這一想法的臨床證據:在糖尿病期間,衰老的內皮細胞在視網膜血管中積累,并導致視網膜微炎癥的升高和血-視網膜屏障的破裂,最終導致視覺功能下降。玻璃體內只需注射一針小分子 BCL-xL抑制劑,即可至少半年內消除衰老的內皮細胞,從而減少局部炎癥和血管的再生并改善屏障功能,最終視覺功能得到了改善(圖6)。
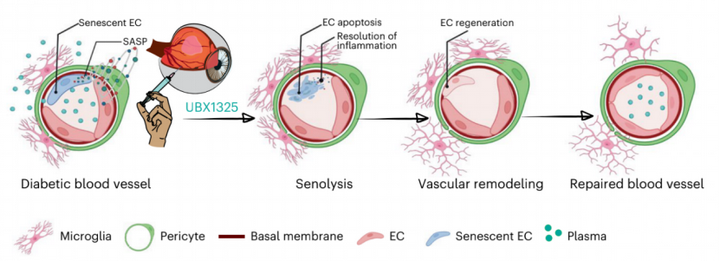
圖6:糖尿病性黃斑水腫中衰老疾病假說的示意圖
展望
UBX1325可能是第一個通過清除衰老細胞改善糖尿病性黃斑水腫的藥物,但它不是最后一個。目前多種抗衰老藥物已被證明可以調節線粒體功能障礙和病理磷酸化信號-這是糖尿病并發癥治療的潛在靶點[9]。線粒體靶點(和相關的衰老藥物)對于糖尿病性黃斑水腫的血管和神經改變的治療還有待評估。磷酸化信號SRC和磷酸肌醇3-激酶可誘導血管內皮細胞中血管通透性,也是抗衰老藥物的靶點。還有一些藥物,如二甲雙胍,**它通過調節而不是去除衰老細胞,**抑制SASP的分泌,并可能減緩與年齡相關的變性。目前基于人工智能AI探究衰老相關靶點的概念驗證和化合物方興未艾,這也極可能有利于糖尿病視網膜疾病患者的治療[10]。
在糖尿病視網膜病變中存在細胞應激和死亡的多種機制,因此針對此概念的治療方式的開發將是非常潛力的方向。清除衰老細胞治療是一種很有前景的新興策略;干細胞移植再生是另一個。目前,Crespo-Garcia 等人的研究標志著治療糖尿病性黃斑水腫的視網膜再生的新時代的開始。### 參考文獻:
- Stitt, A. W. et al. The progress in understanding and treatment of diabetic retinopathy. Prog. Retin. Eye Res. 51, 156–186 (2016).
- Ciulla, T. A., Pollack, J. S. & Williams, D. F. Br. J. Ophthalmol. 105, 216–221 (2021).
- Duh, E. J., Sun, J. K. & Stitt, A. W. Diabetic retinopathy: current understanding, mechanisms, and treatment strategies. JCI Insight 2, e93751 (2017).
- Coppe, J. P. et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 6, 2853–2868 (2008).
- Coppé, J. -P., Desprez, P. -Y., Krtolica, A. & Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu. Rev. Pathol. 5, 99–118 (2010).
- Su, L. et al. Diabetic endothelial cells diferentiated from patient iPSCs show dysregulated glycine homeostasis and senescence associated phenotypes. Front. Cell Dev. Biol. 9, 667252 (2021).
- Oubaha, M. et al. Senescence-associated secretory phenotype contributes to pathological angiogenesis in retinopathy. Sci. Transl. Med. 8, 362ra144 (2016).
- Crespo-Garcia, S. et al. Pathological angiogenesis in retinopathy engages cellular senescence and is amenable to therapeutic elimination via BCL-xL inhibition. Cell Metab. 33, 818–832 (2021). 23. Palmer, A. K. et al
- Murakami, T., Gardner, T.W. Rejuvenation of diabetic macular edema with senolytic therapy. Nat Med 30, 346–347 (2024). https://doi.org/10.1038/s41591-024-02804-2.
- Wong, F., Omori, S., Donghia, N. M., Zheng, E. J. & Collins, J. J. Nat. Aging 3, 734–750 (2023).
來源: BTIT俱樂部


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 BTIT俱樂部
BTIT俱樂部 
