導讀
今年諾貝爾生理或醫學獎授予兩位學者——卡塔琳·卡里科以及德魯·魏斯曼,以表彰他們在mRNA技術上做出的開創性貢獻。
得益于他們的發現以及創新技術,新冠疫苗才能被快速研發出來,挽救了數以百萬計人的生命,如今這項技術也在應用到其他病毒、癌癥等領域。

最近,我們邀請了業內資深專家徐亦迅博士深度解讀mRNA技術。
盡管今年的諾獎沒有獎勵mRNA遞送方面的專家,但徐博士認為,“未來不排除脂質納米顆粒,有單獨獲得一次化學獎的機會。”
徐亦迅 | 嘉賓
周 晨 | 整理
01 mRNA疫苗領域兩位先驅問鼎諾獎
問:今年諾貝爾生理或醫學獎授予mRNA疫苗領域,您覺得是在意料之中還是意料之外?
徐亦迅:兩年前,我就期待著他們能獲得諾貝爾獎,所以今年他們獲獎我并不覺得意外,反而感覺晚了兩年。這一延遲可能對很多重要的決策也有一定影響。

賓夕法尼亞大學為兩位學者獲得諾獎進行慶祝
02 兩位獲獎者的主要貢獻
問:您能評價一下這兩位獲獎者的主要貢獻嗎?為什么是這兩位科學家而沒有第三位可以分享這次諾貝爾獎?
徐亦迅:mRNA技術作為療法的應用可以追溯到很早以前。舉例來說,人體內缺失某種基因后,補充蛋白在操作上會比較復雜,蛋白合成的成本也非常高。多年以來,嘗試去改變DNA一直被視為是不可能的任務,直到2012年CRISPR技術的發明,才讓便捷的基因編輯成為可能。
mRNA的發現可以追溯到1961年,但在2012年之前,我們很難想象能夠輕松編輯DNA。我們應該記得中心法則,即mRNA在DNA和蛋白之間承載遺傳信息。
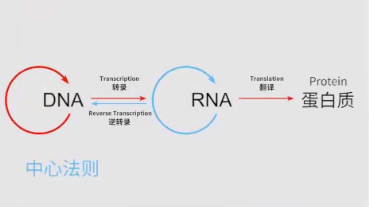
mRNA具有明顯的優勢。如果將mRNA導入體內,去補充那些缺失或變異的蛋白,它有一個最大的好處:由于它不改變DNA,所以是一個非常安全的療法,只要沒有反轉錄酶存在,一般不會整合進人類的基因組。
此外,mRNA在翻譯成蛋白后通常很快會降解。一旦mRNA療法可能出現副作用,它會被及時降解,并且它不會整合進基因組,一旦停止這種治療,可能出現的有害副作用就會逆轉,這也是為什么mRNA療法如此吸引人的原因。
然而,要達到這一點,無論是將mRNA作為療法還是疫苗,都需要解決一個問題:因為mRNA本質上與病毒和細菌相似,一旦以外來途徑進入人體細胞,很容易被人體的先天免疫系統識別為潛在病原體,并產生強烈的炎癥反應,在這種情況下無法實現治療或者疫苗的效果。
兩位科學家在2005年發表的《Immunity》雜志上的論文是一個里程碑式的工作。
在所有的諾貝爾頒獎歷史上,一直強調,從0到1的突破比從1到100的突破更為重要。
問:除了這兩位教授之外,還有其他學者在這一領域做出過重要貢獻嗎?如mRNA的遞送技術方面。
徐亦迅:我在兩年前的講座中也提到了脂質納米顆粒技術的重要性。卡塔琳·卡里科和德魯·魏斯曼在他們的公開演講中也強調了納米脂顆粒(LNP)技術對新冠mRNA疫苗研發成功的重要性。
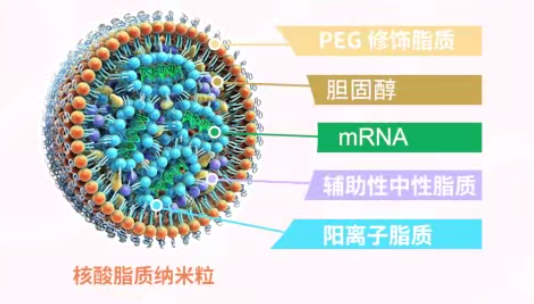
然而,由于諾貝爾獎的名額有限,卡里科和魏斯曼是必得的,只剩下一個名額。如果將這個名額給予納米脂顆粒(LNP),大家也是可以接受的。后來我們知道彼得·庫里斯(Pieter Cullis)似乎在所有納米脂顆粒方面都是一個非常突出的人選。一些獎項確實讓他與卡里科和魏斯曼共同分享。

LNP開創者之一彼得·庫里斯(Pieter Cullis)

但諾貝爾委員會的標準往往強調從0到1的突破,而不是從1到99。
不過未來,不排除脂質納米顆粒有單獨獲得一次化學獎的機會。
03 mRNA技術發展歷程
問:1962年科學家發現了mRNA,但直到60年后,mRNA療法才逐漸成熟。在這期間,科學家先后解決了mRNA的穩定性、免疫源性和遞送問題。您能簡單回溯一下這個療法的發展歷程嗎?
徐亦迅:在兩年前的直播講座中,我分享了一張圖,展示了從1961年到2008年間的mRNA發展歷程,實際上是一個非常形象的發展歷史。
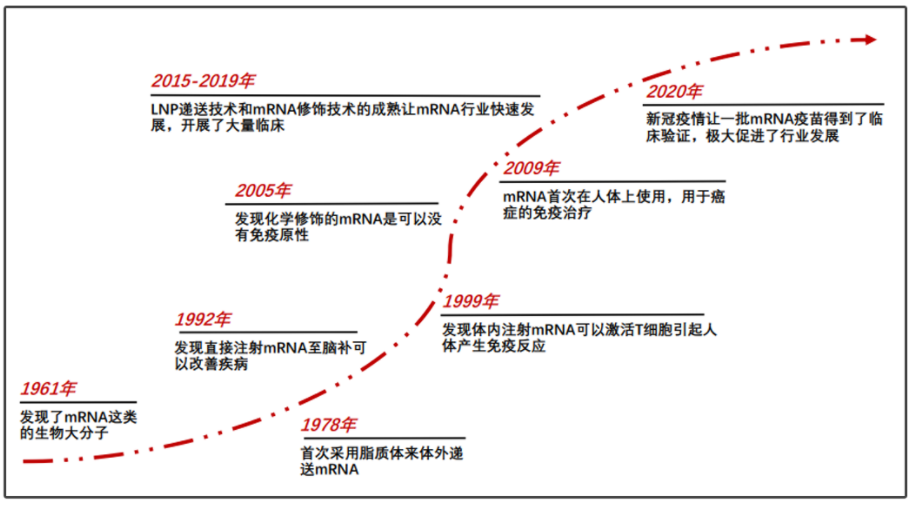
1961年,多家實驗室同時發現了mRNA,此時已有很多人認為這項發現可能獲得諾貝爾獎。然而我估計或許由于人數眾多,所以很難確定哪三個人獲獎。mRNA的發現與諾獎擦肩而過令人遺憾。
隨著分子生物學的不斷發展,面臨的首要挑戰之一是降低合成mRNA的成本。按照中心法則,DNA到mRNA的轉錄,以及mRNA到蛋白的翻譯是關鍵步驟。首先要做的是在體外,即試管中,將DNA片段轉錄成mRNA。在1985年之前還沒有PCR技術,得到大量DNA片段的價格都比較高。
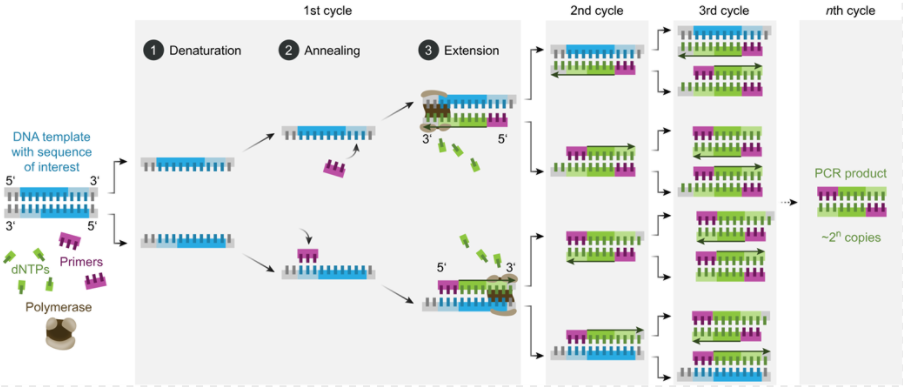
聚合酶鏈式反應
有了PCR技術后,科學家可以輕松獲得足夠的模板DNA,利用RNA聚合酶在體外進行轉錄,就可以輕松獲得大量mRNA。然而,研究人員需要解決mRNA的穩定性問題,因為它容易被降解。卡里科和魏斯曼通過引入核苷的修飾,解決了外源mRNA引發炎癥反應以及其翻譯被干擾素抑制的技術困難。隨后,逐漸找到能夠合適應用的疾病。
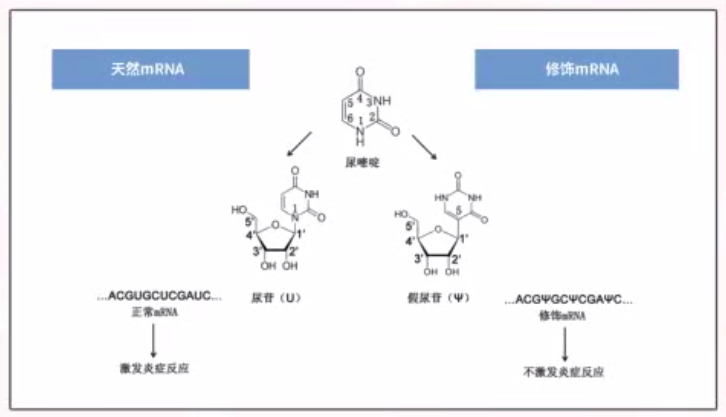
但在之后,將mRNA用作療法在許多疾病中常面臨各種困難,并非所有疾病都可以輕松嘗試mRNA作為療法。
04 mRNA技術在疾病領域的應用
問:mRNA技術因新冠疫情而被人廣泛熟知。除了應對傳染病,它在腫瘤以及其他疾病領域也大有可為。您能否談談您在這方面的看法?
徐亦迅:這是一個非常有趣的問題。實際上,我們可以深入研究兩家憑借mRNA新冠疫苗成功的公司:BioNTech和Moderna。
BioNTech公司成立于2008年,是德國一家優秀的生物技術公司。初創時的目標是用mRNA技術來研發腫瘤產生新抗原的癌癥疫苗。很多年內都沒考慮制作傳染病疫苗,直到新冠疫情爆發讓他們“靈機一動”,通過結合mRNA的核苷修飾技術加上2017年取得突破的納米脂顆粒,組合起來可以來應對新冠疫情的挑戰。
而Moderna公司早期更早想要開發mRNA療法,很多公司給它投錢。但當新冠來襲時,他們將主攻方向的一部分轉向擴增傳染病的mRNA疫苗。此外,他們找到了強大的合作伙伴 —— 美國默沙東公司,從而把很大一部分精力繼續投入到新抗原腫瘤疫苗。在過去一兩年中,他們的Ⅱ期臨床數據表現非常出色,尤其在黑色素瘤領域。
這兩家公司明白新冠疫情已經過去,于是很快將把下一個增長點放在新抗原的mRNA疫苗上。
至于其他疾病的療法,正如此前說的mRNA作為一種“缺啥補啥”療法,有很多公司在做,但是短期內尚未看到即將取得突破性進展的跡象。不過總的來說,這個領域的發展必定是未來大家想努力的方向。
05 mRNA技術的未來
問:在業內很多專家看來,mRNA技術可能會給生物醫藥領域帶來巨變,甚至將其稱為mRNA醫學。您對這個技術未來發展前景有何評價?
徐亦迅:這種前景確實存在,然而我強烈呼吁大家不要對其過度炒作。因為mRNA在疫苗研發上的成功有它的道理。
很多時候,事情恰好發生在特定時間點上。mRNA技術發展受益于新冠病毒的刺激,全球政府迅速投入大量資金,以超快的速度共同應對全人類面臨的共同危機。
這也解釋了為何這一技術能夠在短短一兩年內促使卡里科和魏斯曼獲得諾貝爾獎,它是有很多特殊原因的。
在正常情況下,許多疾病已經有其他的治療方法。要推進mRNA作為一種新療法,必須解決比現有療法更具優勢的問題。然而,如果要在已有療法的疾病領域成功推動mRNA療法的發展,就必須克服許多技術上的困難。
06 mRNA藥物開發的優勢
問:過去,藥物的研發周期很長、成本極高,而mRNA藥物具有短研發周期的優勢,對于這一點,您有何看法?
徐亦迅:研發周期的縮短是相對而言的,因為mRNA具有序列易變的特性。
舉例來說,在疫苗領域,這實際上是一個巨大的優勢,尤其是針對那些經常發生變異的病毒。你可以隨時修改序列以跟上病毒變異的速度。此外,mRNA的生產過程已經非常成熟。

然而,我仍然要提醒大家,臨床試驗這一階段通常不是你想快就能快得起來的。它往往是一個“限速”步驟,也就是說,盡管上游的生產和其他過程可以加速,周期可以相對縮短,但要找到一種疾病是否適合這個療法并不是那么簡單。而且一旦找到適用的疾病,需要招募愿意參與臨床試驗的患者,還要與已有的成熟療法做頭對頭的比較,這個過程不容易快起來的。因此,大家不應輕易高估mRNA療法研發的速度。
07 AI如何助力mRNA藥物開發
問:這兩年AI很熱,并在mRNA序列設計以及驗證上有很大的優勢。對此,您怎么看?二者的結合能否在未來加速mRNA疫苗藥物的開發?
徐亦迅:首先簡單評價一下,所謂的AI制藥是一個難以精確描述的概念。
我們傳統意義上提到的AI主要指深度神經網絡,如大家熟知的AlphaGo。2020年出現了AlphaFold,尤其是2021年的AlphaFold2在蛋白質結構預測方面取得了非常了不起的成就。這些能夠預測蛋白質結構的AI工具對藥物研發確實起到了重要作用,尤其是在分析小分子化合物或抗體與目標蛋白結合時,通過算法分析這些結構的變化可以提供很大的幫助。
此外,還可以利用深度學習篩選小分子藥物文庫,做虛擬的小分子藥物庫。一些公司甚至能夠根據靶標蛋白的結構設計有機小分子,使其能夠與蛋白良好結合。
但是最新的AI技術,比如ChatGPT這類深層次AI,對生物序列可能也有一定的作用,因為它是大型語言模型,而生物序列,無論是DNA、RNA還是蛋白質序列,與人類語言有一定的相似性。因此,使用類似于GPT的算法可能對設計抗體序列或mRNA序列有一定的幫助。
然而,我仍要強調,我們不應過分神化這些工具,也不要對AI制藥概念進行夸大炒作。
08 如何堅持科學研究方向?
問:無論是卡里科還是其他諾獎得主,我們可以從他們的科研道路中得到一些啟示。例如,如何在困難時期保持執著,不放棄自己的研究方向,如何堅持科研的原創性?
徐亦迅:簡而言之,卡里科的職業生涯可以總結為相當曲折,因為她并不完全適應美國生命科學研究的規則。

她幸運地遇到了命中注定的貴人——魏斯曼。如果不是魏斯曼在1997年“救場”,她可能無法繼續她熱愛的mRNA療法研究。當然,卡里科本身就是一個非常堅韌不拔的人。在1995年被賓大降職以及40歲時患癌癥的雙重打擊下,她仍決定不放棄對mRNA療法的研究方向,這種堅持難能可貴。
然而,這種堅持并非適用于所有科學家,因為有時候某些研究方向可能確實會陷入“死胡同”,而保持靈活頭腦,轉向其他方向未必是壞事。
卡里科是一個個例,由于她在mRNA領域的深厚積累,她對mRNA療法的信心具有科學依據,這也是她能夠與魏斯曼產生共鳴的原因,因為魏斯曼作為新晉助理教授,有很多研究方向可選。如果他沒有與卡里科看到相似的研究路徑,就不會有如此默契。
本文為科普中國·星空計劃扶持
作品團隊/作者:深究科學
審核:陶寧 (中國科學院生物物理研究所副研究員)
出品:中國科協科普部
監制:中國科學技術出版社有限公司、北京中科星河文化傳媒有限公司

來源: 深究科學


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 深究科學
深究科學 
