成像質譜(Imaging Mass Spectrometry, IMS)憑借其「無標記、多分子同步成像、空間定位與定量結合」的優勢,在生物學領域被廣泛應用。相較于傳統質譜技術,IMS 能夠以非靶向、高度復用的模式對生物組織中的分子種類進行映射,實現在組織、細胞甚至亞細胞水平上多成分分布的可視化。 IMS 的高空間分辨率優勢,使其在藥物靶標定位、代謝物空間分布和炮制機理研究等領域展現出巨大潛力,推動了轉移癌、阿爾茨海默癥、帕金森病等重大疾病的診斷與檢測。
IMS 具備廣泛的分子覆蓋范圍和高度的化學特異性,但是,大多數 IMS 平臺缺乏顯微鏡級別的空間分辨率和細胞形態對比度,很難在沒有更多信息的情況下將分子譜與精確的細胞特征直接聯系起來。為解決這一限制,研究人員提出了將 IMS 數據與光學顯微鏡相結合的多模態方法,開發了 IMS-顯微鏡集成方法,通過 IMS 數據的空間銳化、樣本外分子分布預測、基于顯微鏡特征挖掘 IMS 衍生的分子譜等,路徑增強 IMS 數據的可解釋性。
然而,多模態方法對組織化學染色明場圖像(Bright-field Image)或免疫熒光圖像的依賴,加劇了實驗的復雜性。在這一背景下,來自 UCLA 的研究團隊提出了一種基于擴散模型的虛擬組織學染色方法,增強空間分辨率,并以數字化的方式將細胞形態對比度引入無標記人體組織的質譜圖像中,實現了基于低分辨率 IMS 數據預測高分辨率細胞組織病理結構,簡化了分子組織學中 IMS 多模態方法的工作流程。此外,該研究還在擴散模型的推理過程中使用了優化的噪聲采樣,從而實現了可重復的虛擬染色。
相關研究成果以「Virtual staining of label-free tissue in imaging mass spectrometry」為題,發表于 Science Advances 。
研究亮點:
* 首次將布朗橋擴散模型(Brownian Bridge Diffusion Model, BBDM)應用于 IMS 數據,實現從無標記組織的低分辨率離子圖像到高分辨率虛擬染色圖像的轉換;
* 優化噪聲采樣策略,在反向擴散過程中引入確定性均值采樣策略;
* 提出基于信噪比(Signal-to-Noise Ratio, SNR)的通道選擇策略,驗證了 IMS 分子信息的冗余性及高效利用方式。
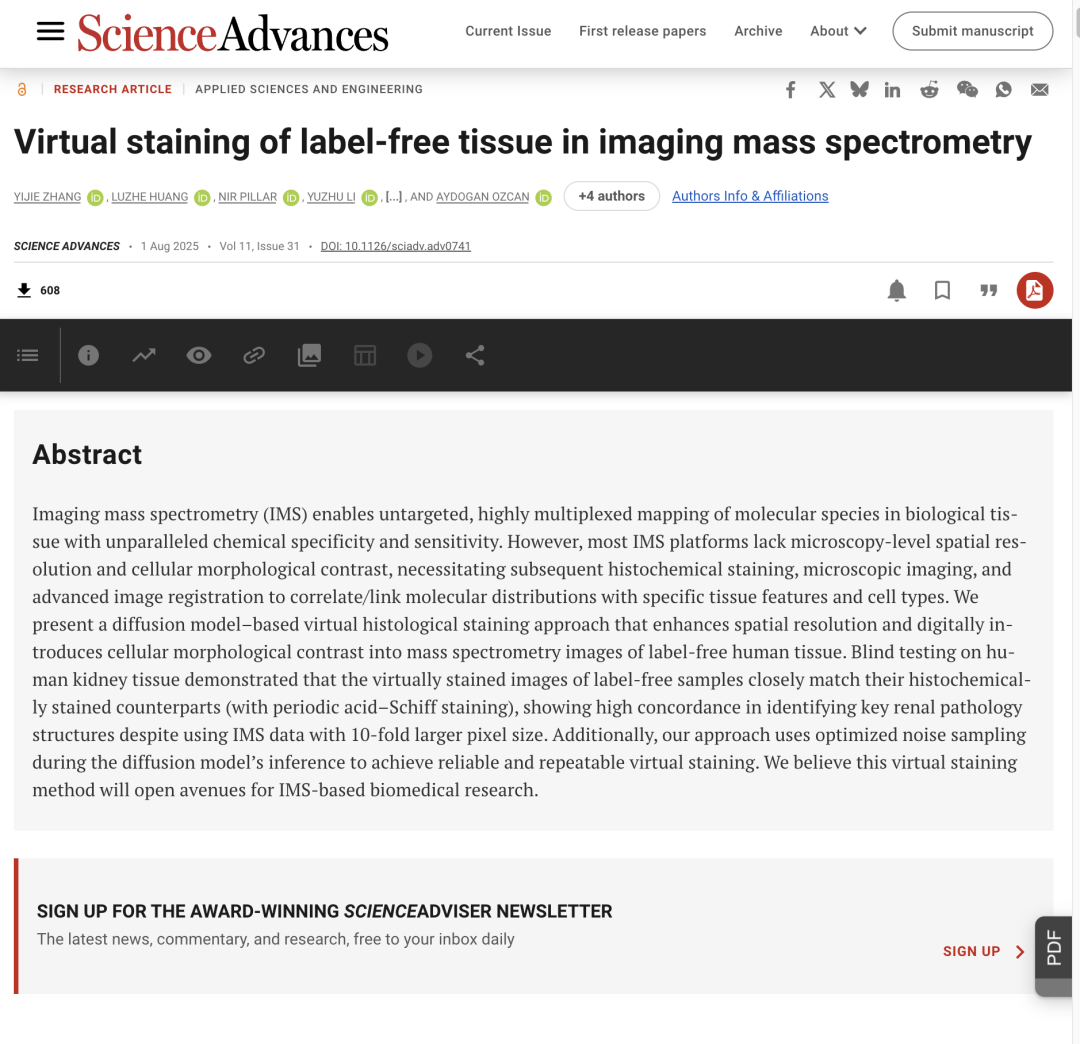
無標記組織質譜數據集預處理
該研究使用的數據集包含無標記人腎組織的成像質譜離子圖像(Ion Image),以及相同組織樣本的高分辨率明場圖像(Bright-field Image)。其中,每個組織樣本的 IMS 數據均采用橫向間距為 10 μm 的像素級光柵掃描獲取,共產生了包含 1,453 個質荷比通道的單個離子圖像。
在通過像素級光柵掃描獲取 IMS 數據后,將高分辨率組織樣本的明場圖像與對應的 IMS 離子圖像進行配準,形成無標記輸入(Label-free Imput)和明場染色圖像(Bright-field and Labeled)圖像對。為輔助配準,研究團隊還在 IMS 數據采集前后獲取了組織切片的自發熒光(Autofluorescence)顯微鏡圖像。
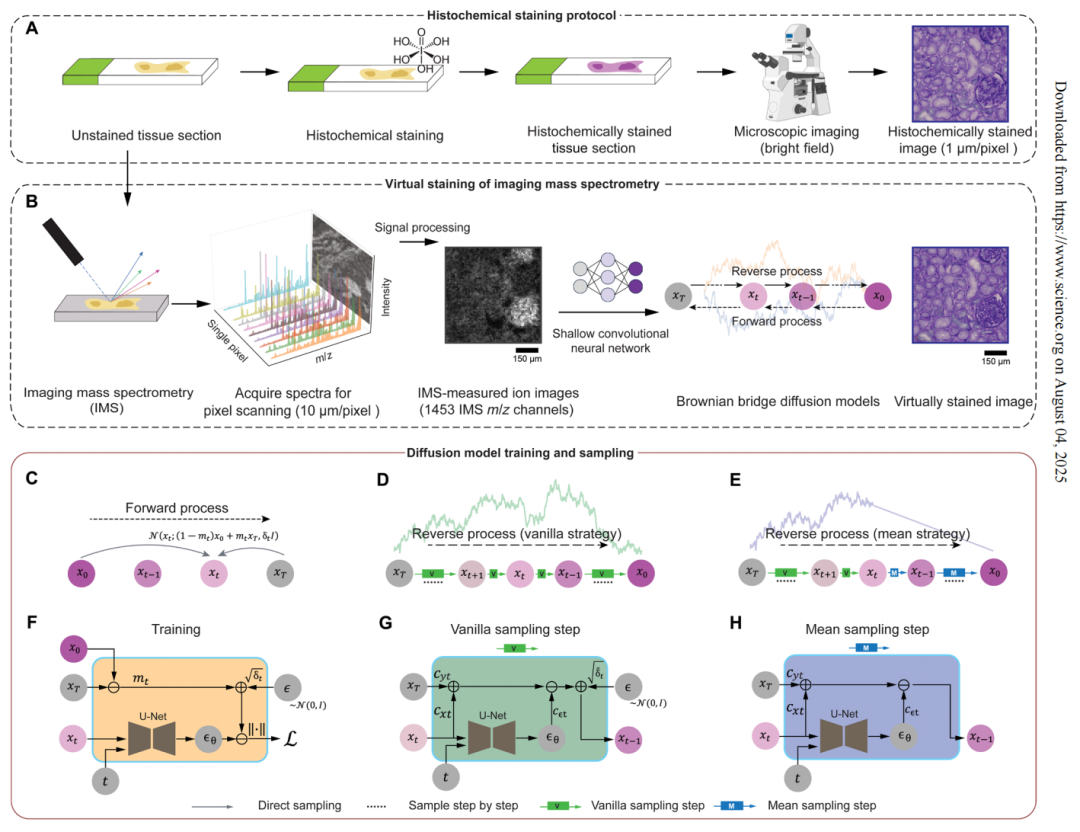
基于擴散模型的虛擬染色流程
該研究對原始 IMS 數據的預處理分為 4 個步驟:
* 將原始數據導出為自定義二進制格式并重新構建為偽輪廓質譜圖;
* 基于內部識別峰對齊數據,校正譜圖錯位;
* 使用內部識別峰的理論質量數校準數據集質量軸;
* 計算歸一化校正因子,采用總離子流法對質譜和離子圖像進行歸一化,并基于所有像素計算每個數據集的平均質譜圖。
實驗采用的數據集共包含 14 名患者的組織樣本圖像數據,其中,4 名患者的 712 對增強后的 IMS-PAS 顯微圖像塊用于模型訓練,其余患者的 201 對未增強的 IMS-PAS 顯微圖像用于模型測試。
基于雙向布朗橋擴散模型的虛擬組織學染色
在該研究中,團隊基于布朗橋擴散模型(Brownian Bridge Diffusion Model, BBDM)的核心生成框架,將無標記成像質譜數據轉換為虛擬染色圖像。與傳統的布朗橋設計不同,該擴散模型采用了雙向的布朗橋設計,保證其正向過程與經典去噪擴散概率模型相反,實現了從目標高分辨明場圖像向低分辨率的 IMS 輸入圖像退化,其反向過程則能夠根據 IMS 輸入數據直接重建目標圖像。
此外,布朗橋擴散模型在采樣階段采用了確定性的均值采樣策略,提升了生成圖像的一致性和可重復性。而在該策略達到特定時間點后,在標準的隨機采樣過程中引入的后驗噪聲將被消除,相較于以純噪聲為終點并全程依賴條件信號的模式,布朗橋擴散模型實現了更穩定的圖像轉換。整個推理流程僅需輸入低分辨率的 IMS 數據,就能通過模型逐步去噪生成高分辨率的虛擬染色圖像。
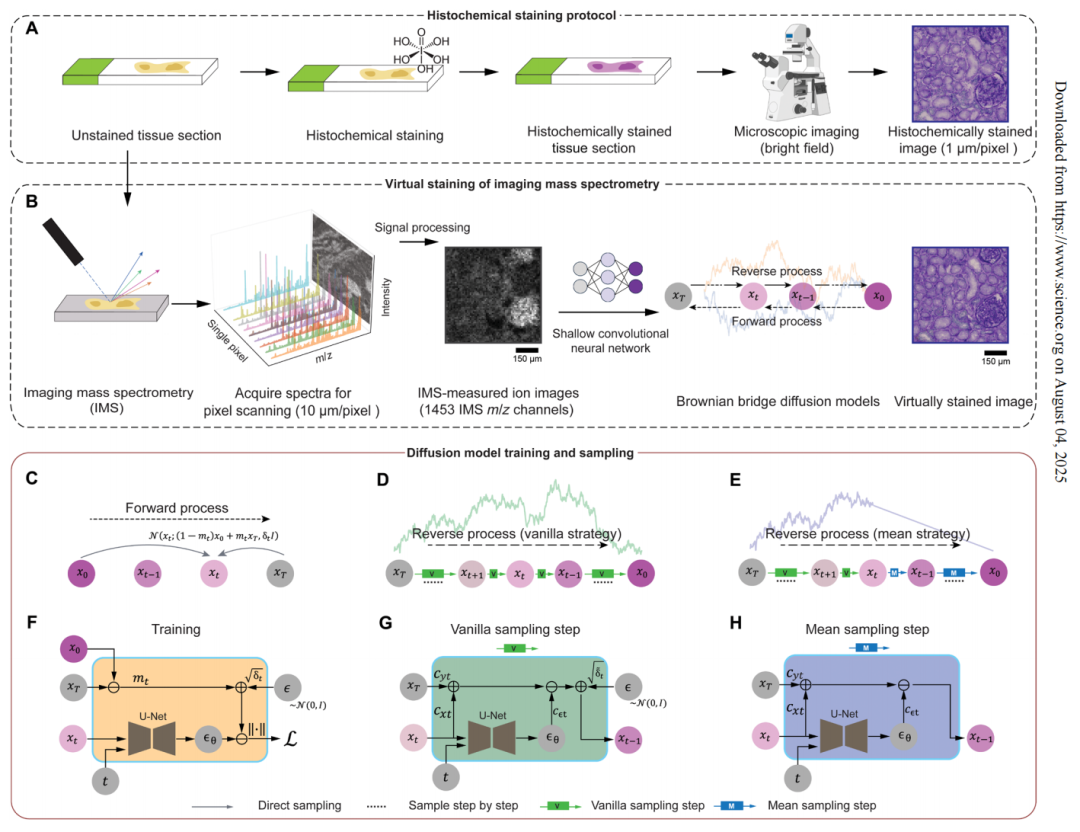
基于擴散模型的無標記 IMS 測量離子圖像的虛擬染色流程
訓練完成后,該研究使用未經訓練驗證的獨立人腎組織測試數據集對布朗橋模型進行了評估。從實驗結果表征來看,擴散模型基于分辨率更低的 IMS 數據生成的虛擬染色圖像,在視覺上與真實的明場染色圖像呈現出較高一致性。
同時,關鍵腎臟結構在虛擬染色圖像和真實染色圖像上也顯示出高度相似的結果,充分驗證了該布朗橋框架在將低分辨率 IMS 數據虛擬染色方面的魯棒性和良好的泛化能力。
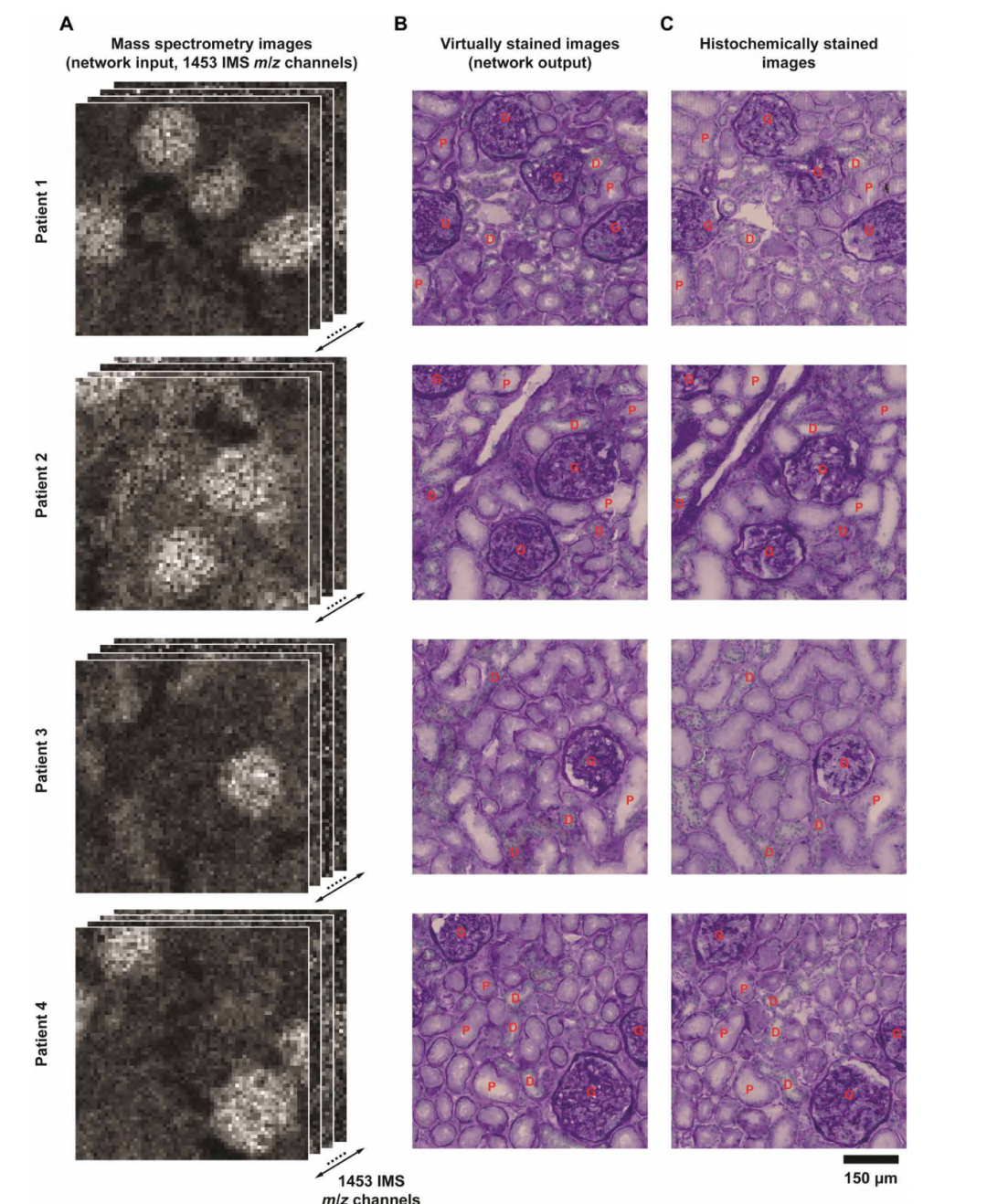
不同患者和高分辨率對照組的無標記 IMS 數據生成的虛擬染色 PAS 圖像的視覺比較
虛擬染色模型性能定量評估
實驗通過空間頻譜與顏色分布分析,證實了虛擬染色模型具備顯著的超分辨率能力。從空間頻譜分析來看,相較于輸入的低分辨率質譜圖像,高分辨率圖像的空間頻譜在所有頻率范圍內相對增幅較大,實現了分辨率的本質提升。同時,虛擬染色圖像與高分辨率真實染色圖像的徑向平均功率譜高度吻合,精準還原了生物結構的空間頻率特征。
同時,未配對高分辨率圖像的對比實驗進一步驗證了虛擬染色模型的特異性。實驗顯示,非配對樣本的頻譜特征與配對結果存在顯著差異,配對低分辨率和高分辨率圖像的顏色直方圖相似性顯著優于非配對樣本,驗證了模型對組織化學染色固有顏色特征的復現能力。
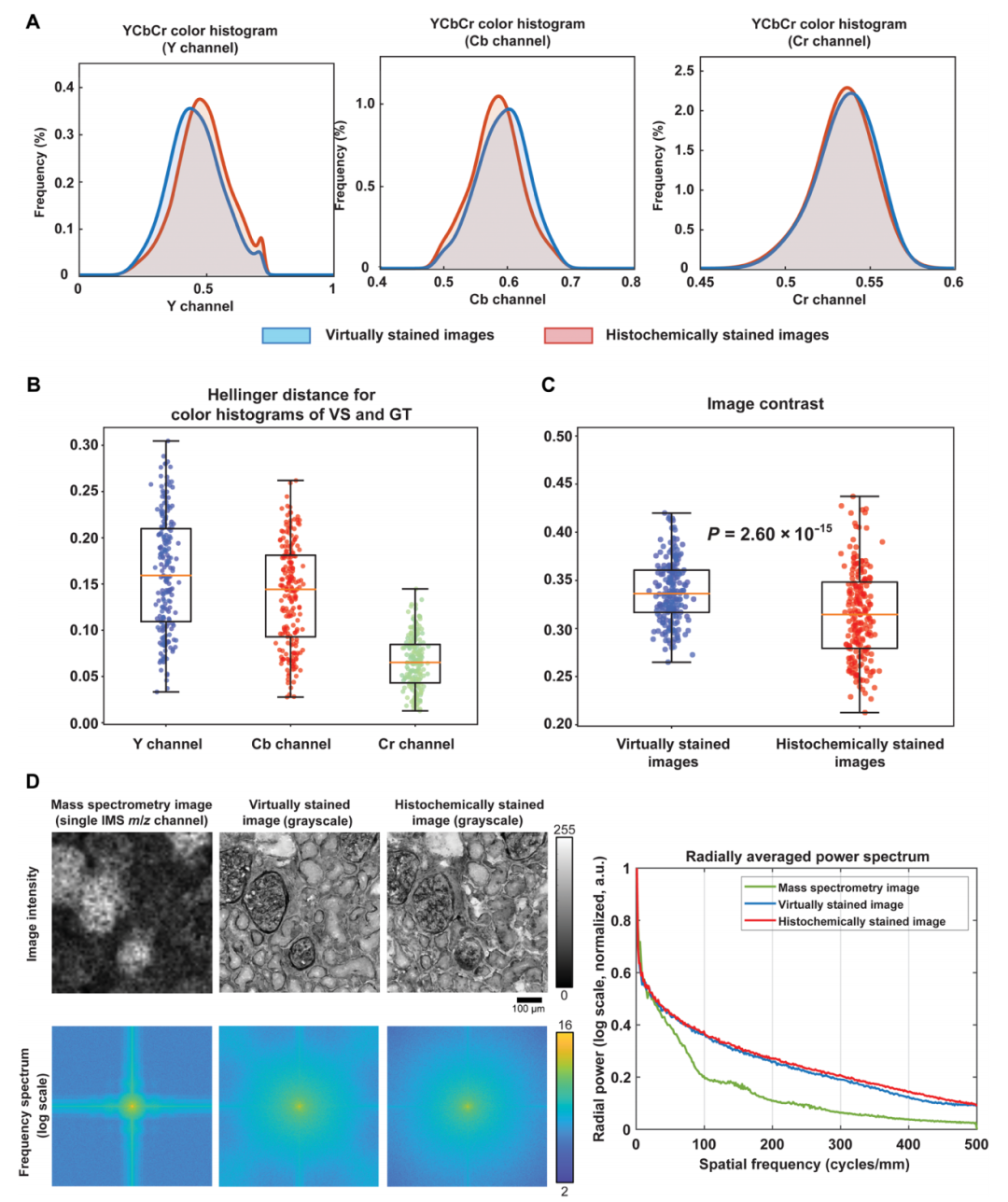
由無標記 IMS 數據生成的虛擬染色 PAS 圖像與其 HS 對應圖像之間的定量比較
質譜圖像通道數量
為探究質譜成像通道數量對虛擬染色模型性能的影響,該研究比較了不同通道數量的染色策略。研究團隊基于固定測試數據集對一系列配備不同 IMS 通道數量的虛擬染色模型進行了評估,其中,模型 IMS 通道數量分別為 363 個、 91 個、 23 個,和最初的 1,453 個相比,分別對應 4 倍、 16 倍和 64 倍縮減。實驗針對每種縮減程度的通道,評估了三種不同的選擇策略:
* 信噪比優先策略: 根據信噪比對 1,453 個通道進行降序排序,選取排名最高的通道;
信噪比:通道內所有像素的均值 / 標準差。
* 頻率優先策略: 對每個通道的離子圖像進行二維傅立葉變換,計算高頻分量與低頻分量平均功率的比值,并根據該比值降序排序選取通道;
* 均勻采樣策略: 從第一個通道開始,按固定間隔選取通道,如 4 倍縮減取每第 4 個通道,16 倍取每第 16 個,64 倍取每第 64 個,每種策略選定的通道集合在其對應模型的整個訓練和測試過程中保持一致。
評估結果顯示,隨著使用的 IMS 通道數量從 1,453 個減少至 23 個,三種策略下的虛擬染色模型性能均出現下降情況,核形態等關鍵特征出現明顯缺失。該研究使用峰值信噪比、學習感知圖像塊相似度(Learned Perceptual Image Patch Similarity, LPIPS)和皮爾遜相關系數,在測試集上進行定量分析后驗證得出,虛擬染色模型的保真度會隨通道數量的增加顯著提高。
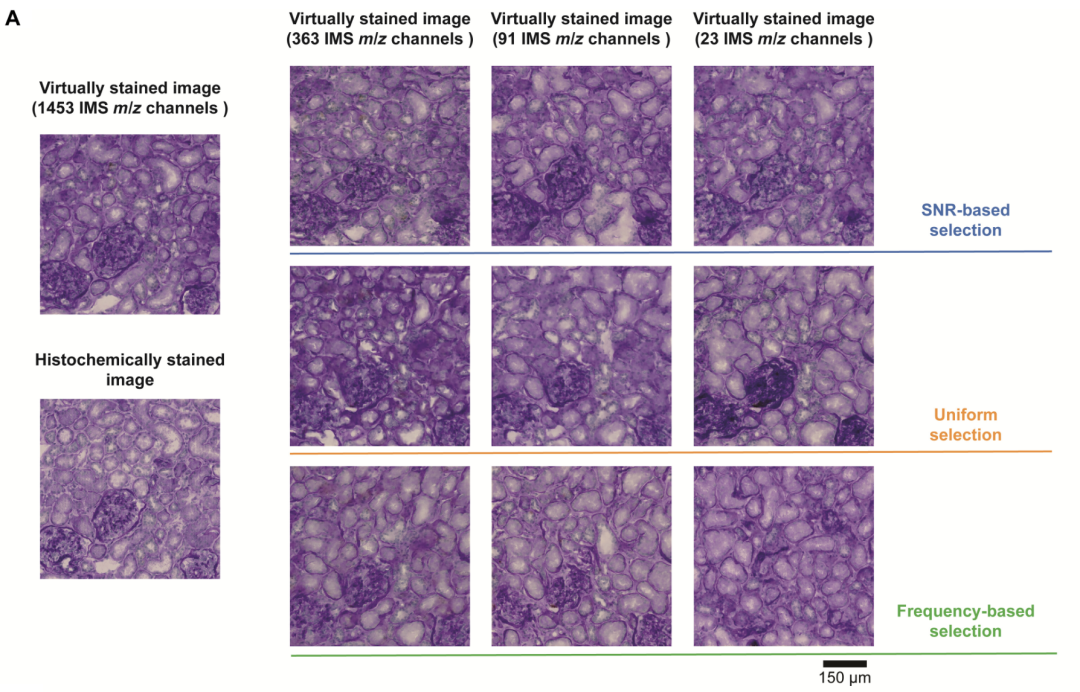
通過三種不同選擇策略獲得的虛擬染色圖像的視覺比較
此外,在三種通道選擇策略中,信噪比優先策略和頻率優先策略及均勻采樣策略相比,均表現出顯著的性能優勢,驗證了虛擬染色模型在通道數量少時能更有效地保留關鍵分子信息的性質。
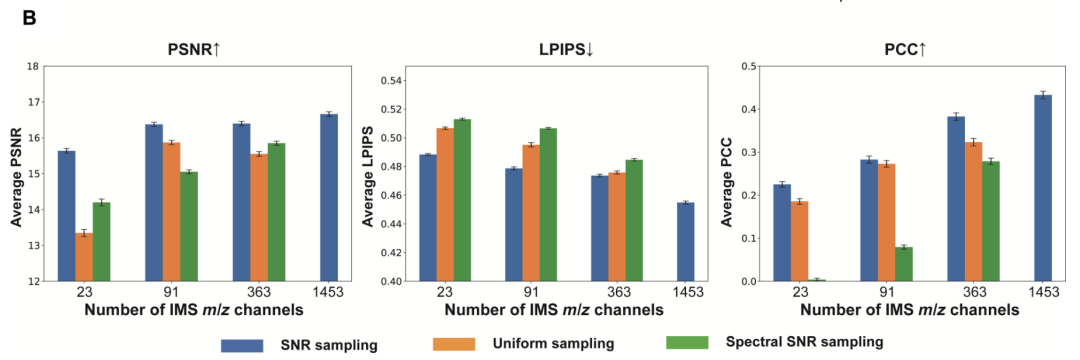
所有配置的虛擬染色測試圖像的平均峰值信噪比、學習感知圖像塊相似度和皮爾遜相關系數定量指標
噪聲采樣,減少虛擬染色模型輸出方差
在基于擴散模型的虛擬染色中,逆向擴散過程的噪聲采樣隨機性成為輸出結果波動的主要誘因。為解決輸出結果波動,該研究提出了無需微調模型的噪聲采樣工程策略,通過規避逆向擴散末期噪聲方差的激增以提升相同無標記組織視野下虛擬染色結果的一致性。研究團隊基于受訓的布朗橋模型對比了三種采樣方式:
* 原始采樣(Vanilla):標準逆向擴散過程;
* 均值采樣(Mean Sampling):在工程退出點(Engineered Exit Point)后對噪聲路徑取平均;
* 跳躍采樣(Skip Sampling):在工程退出點后直接通過去噪網絡預測高分辨率明場圖像的目標圖像域。
工程退出點是擴散模型逆向生成過程中人為設定的關鍵時間閾值,用于在噪聲采樣路徑中切換隨機采樣與確定性計算策略,以抑制輸出結果的隨機波動。
該研究對三種采樣方法均進行了 5 次重復,并通過計算重復虛擬染色過程間的像素方差系數對其一致性進行了評估,而與原始方法相比,均值采樣和跳躍采樣策略均有效降低了采樣虛擬染色圖像中的方差。

使用三種采樣策略獲得的虛擬染色圖像的 YCbCr 通道變異系數的可視化圖像
此外,研究人員還計算了測試圖像無標記組織視野中所有像素的平均像素方差值。從結果表征來看,與原始采樣相比,均值采樣和跳躍采樣策略均可有效實現較低的輸出方差,證明了該策略下基于擴散的虛擬染色過程具有可重復性。
同時,與均值采樣方法相比,跳躍采樣策略產生的平均變異系數值較低。然而,均值采樣策略產生的結果與經染色處理的組織切片高分辨率圖像的呈現出更高的感知相似性,實現了所需的較低平均學習感知圖像塊相似度。
此外,該研究還對同一組織視野的不同推理測試結果進行了平均,進一步評估了均值采樣策略的性能。結果顯示,均值采樣策略僅在高一致性優先于圖像對比度的場景下表現出更強大的性能。
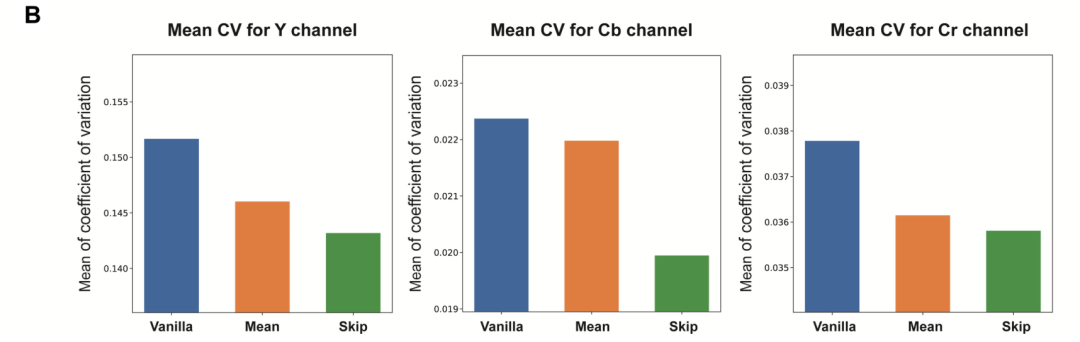
三種采樣策略在所有測試圖像視野上計算得出的平均變異系數
虛擬染色解析新范式
基于擴散模型的虛擬染色技術,正成為解析無標記組織形態的新范式。此前,來自 UCLA 的 Aydogan Ozcan 團隊已在擴散模型與組織染色的結合領域多次取得突破。 2025 年 5 月,該團隊就使用布朗橋擴散模型增強無標記虛擬組織染色的空間分辨率和保真度,對無標記組織進行了像素超分辨虛擬染色,解決了傳統基于深度學習方法的局限性。
該研究團隊將采樣技術集成到基于擴散模型的圖像推理過程中,顯著降低了生成的虛擬染色圖像的方差。研究團隊將該像素超分辨率虛擬染色模型盲應用于無標記人肺組織樣本的低分辨率自發熒光圖像時顯示,其在分辨率、結構相似性和感知精度方面始終優于傳統方法,并成功實現了 4 至 5 倍的像素超分辨率。這一研究為臨床診斷領域研究提供了具有巨大潛力的新路徑。
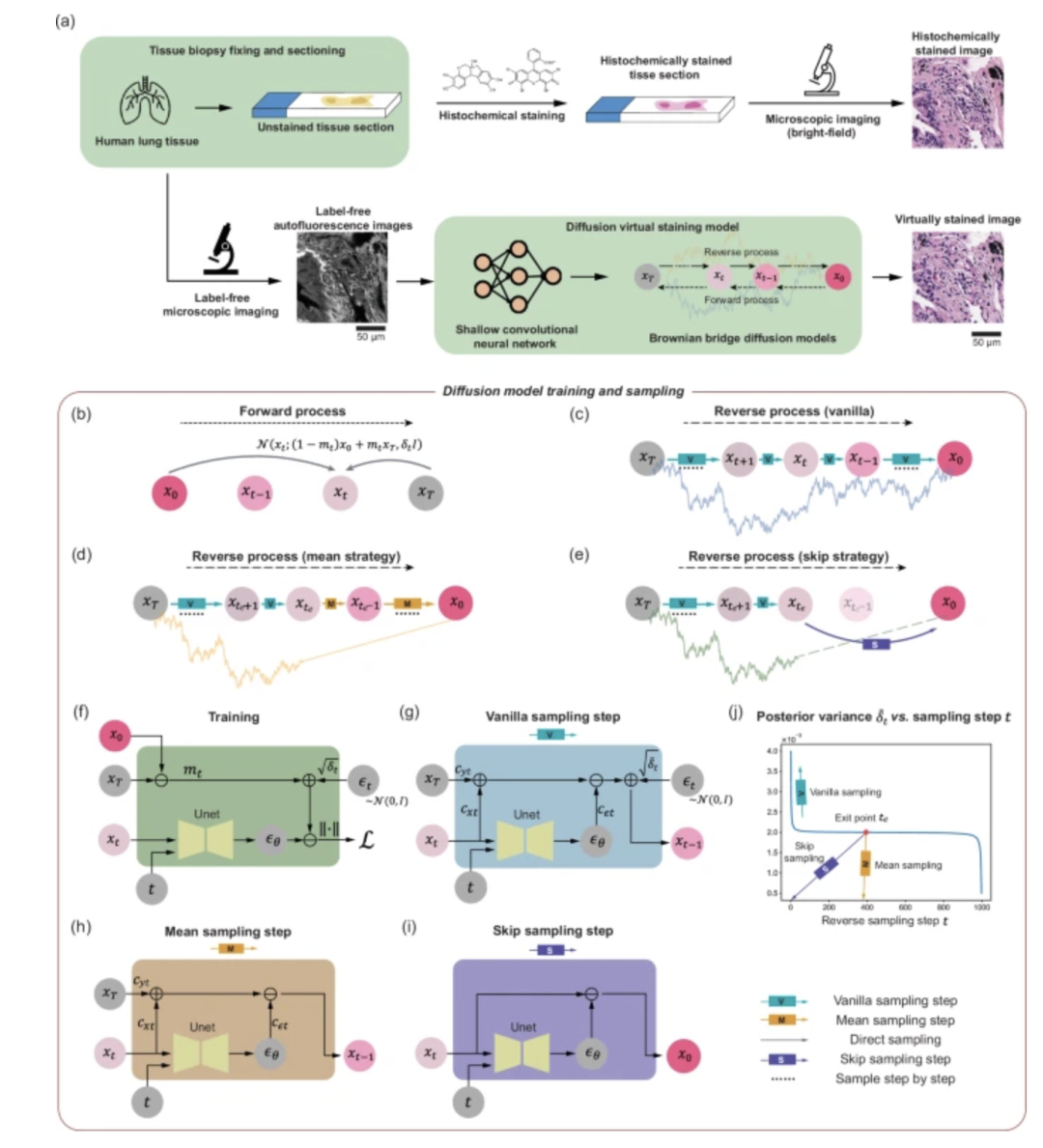
基于擴散模型的未標記組織切片的超分辨率虛擬染色
該研究成果以「Pixel super-resolved virtual staining of label-free tissue using diffusion models」為題,發表在 Nature Communications 。
AI 在虛擬組織染色技術領域的持續進展,減輕了傳統組織化學染色過程中的繁瑣步驟。而針對此類虛擬染色的組織圖像中可能存在的幻覺、偽影,Aydogan Ozcan 團隊還提出了一種用于虛擬組織染色和數字病理學的自主質量和幻覺評估模型 AQuA 。
AQuA 能夠在無需獲取組織化學染色真實值的情況下,在檢測可接受和不可接受的虛擬染色組織圖像時,實現 99.8% 的自主準確率,與經認證的病理學家的手動評估結果一致性達到了 98.5%,在各種虛擬和組織化學染色的人體組織圖像中展現出廣泛的適應性。
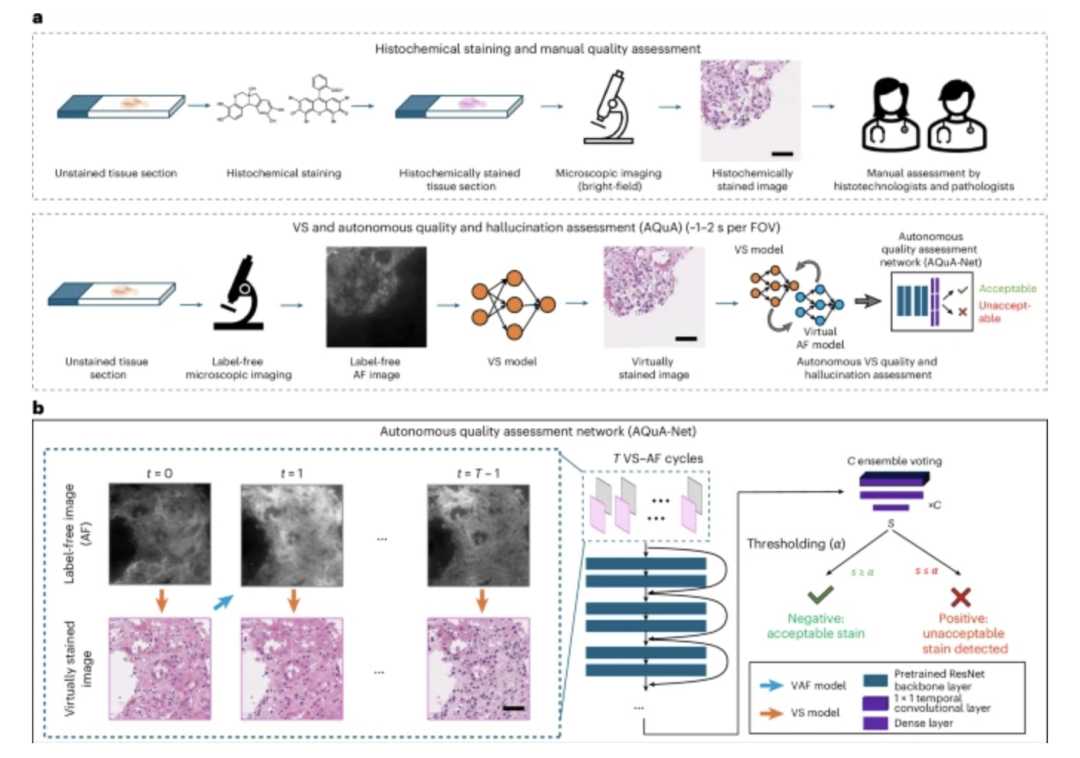
圖像質量和幻覺評估模型流程
該框架增強了虛擬組織染色的可靠性,并為數字病理學和計算成像中的圖像生成和轉換任務提供了自主的質量保證。相關研究成果以「A robust and scalable framework for hallucination detection in virtual tissue staining and digital pathology」為題,發表在 Nature Biomedical Engineering 。
除虛擬染色技術之外,AI 在臨床診斷領域的應用正以前所未有的廣度和深度展開。 AI 模型對海量醫療數據的高效整合,正在為癌癥等重大疾病催生更精準的早期風險預測方案。 AI 在提升了臨床效率的同時,也正在逐步改變傳統的醫療評估、決策和治療模式。
來源: HyperAI超神經


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 HyperAI超神經
HyperAI超神經 
