1912年8月13日,柏林病理研究所的燈光徹夜未熄,德國科學家西奧多?鮑維里站在顯微鏡前,手中的載玻片映著微弱的燭光,他注視著那些異常增殖的細胞——它們形態(tài)怪異,細胞核扭曲如迷宮,與周圍健康組織的規(guī)則排列形成刺眼對比。這一天,他在《細胞增殖與腫瘤形成》的研究報告中首次清晰描述了“癌細胞”的特征,標志著人類對這種致命疾病的認知進入細胞生物學時代。

突破前夜:迷霧中的腫瘤研究
在鮑維里的發(fā)現(xiàn)之前,人類與癌癥的對抗已持續(xù)數(shù)千年。古埃及紙草書(約公元前1600 年)記載了乳房腫瘤的燒灼療法,古希臘名醫(yī)希波克拉底將其命名為 “karkinos”(螃蟹),形容腫瘤蔓延時如蟹爪般頑固附著。但直到 19 世紀,醫(yī)學界仍普遍認為腫瘤是“體液失衡”或“組織退化”的產(chǎn)物,如同腐爛的果實,而非具有活性的病變實體。

人類史上第一部醫(yī)學著作——艾德溫?史密斯紙草文稿,第一次描述了8例乳腺癌和子宮癌
19世紀中期的顯微鏡技術革命為突破奠定了基礎。德國病理學家魯?shù)婪?魏爾肖提出“細胞病理學”理論,指出“一切疾病都源于細胞的異常”,這為腫瘤研究提供了全新框架。他在1858年觀察到癌細胞的細胞核增大、染色加深等現(xiàn)象,但受限于當時的染色技術和細胞分裂理論,未能揭示其本質(zhì)。

中世紀的外科醫(yī)生采用原始的外科手術來治療癌癥
西奧多?鮑維里的創(chuàng)新在于將染色體研究與腫瘤發(fā)生聯(lián)系起來。這位曾以海膽卵實驗揭示染色體遺傳功能的科學家,注意到癌細胞分裂時染色體分配極度混亂——正常細胞分裂時染色體如同訓練有素的士兵整齊列隊,而癌細胞的染色體卻像潰散的軍隊,隨機分配到子細胞中。1912年8月13日,他在實驗記錄中寫道:“這些細胞的分裂不再遵循自然法則,它們獲得了無限增殖的‘自由’,卻也因此成為機體的叛逆者。”

德國病理學家魯?shù)婪?魏爾肖建立細胞病理學,是細胞病理學之父,認為癌癥是由慢性刺激引起
微觀世界的叛逆者:癌細胞的本質(zhì)特征
鮑維里的發(fā)現(xiàn)揭開了癌細胞的三大核心特征,這些特征至今仍是腫瘤研究的基礎。
首先是染色體不穩(wěn)定性。他通過對比正常細胞與癌細胞的分裂過程發(fā)現(xiàn),癌細胞的染色體數(shù)目和結(jié)構(gòu)始終處于混亂狀態(tài)。健康細胞分裂時,染色體精確復制并平均分配,如同精密鐘表的齒輪;而癌細胞中,染色體可能斷裂后錯誤連接,或在分裂時分配不均,導致子細胞染色體數(shù)目異常。這種混亂就像細胞的“遺傳密碼” 不斷出錯,最終使細胞功能徹底失控。
其次是無限增殖能力。正常細胞在分裂一定次數(shù)后會自然衰老死亡,這被稱為“海夫利克極限”;而癌細胞突破了這一限制,獲得了永生化特性。鮑維里在實驗中觀察到,即使在體外培養(yǎng)環(huán)境中,癌細胞也能無視增殖信號的調(diào)控,持續(xù)分裂形成堆積的細胞團,這種“永動機”般的特性使其能在體內(nèi)形成不斷擴張的腫瘤。
最重要的是侵襲與轉(zhuǎn)移能力。他在解剖腫瘤樣本時發(fā)現(xiàn),癌細胞并非局限于原發(fā)部位,而是能穿透組織屏障,侵入周圍正常組織。更可怕的是,這些細胞還能進入血液或淋巴系統(tǒng),隨循環(huán)到達身體其他部位形成新的腫瘤(轉(zhuǎn)移灶)。這種“游走”能力正是癌癥難以根治的關鍵,如同脫離指揮的散兵游勇,在機體各處制造破壞。
跨越百年的科學接力:從發(fā)現(xiàn)到靶向治療
鮑維里的發(fā)現(xiàn)如同在黑暗中點燃的火炬,照亮了后續(xù)百年的癌癥研究之路。1953年DNA雙螺旋結(jié)構(gòu)的發(fā)現(xiàn),為理解癌細胞的遺傳突變提供了鑰匙;1970年代,科學家發(fā)現(xiàn)原癌基因和抑癌基因的突變是細胞癌變的分子基礎,證實了鮑維里關于“遺傳異常導致癌變”的猜想。
1986年,首個癌基因(RAS基因)的致癌機制被闡明,標志著癌癥研究進入分子時代。研究者發(fā)現(xiàn),癌細胞中積累的基因突變就像一連串失靈的開關,有的使細胞過度增殖(原癌基因激活),有的使細胞失去自我糾錯能力(抑癌基因失活)。這些發(fā)現(xiàn)催生了靶向治療藥物——與傳統(tǒng)化療“不分敵我”地殺傷細胞不同,靶向藥物能精準識別癌細胞的特定突變,如針對 HER2 基因擴增的乳腺癌藥物赫賽汀,或抑制 EGFR 突變的肺癌藥物易瑞沙。
免疫治療的興起則從另一個維度延續(xù)了鮑維里的探索。他曾在研究中注意到,部分腫瘤會被機體“自然清除”,這一現(xiàn)象在百年后被證實與免疫系統(tǒng)有關。2013年,免疫檢查點抑制劑(如PD-1抑制劑)的應用,通過解除癌細胞對免疫系統(tǒng)的抑制,讓人體自身的防御系統(tǒng)重新識別并攻擊腫瘤,這種“以彼之道還施彼身”的療法,已使多種晚期癌癥患者的生存期顯著延長。
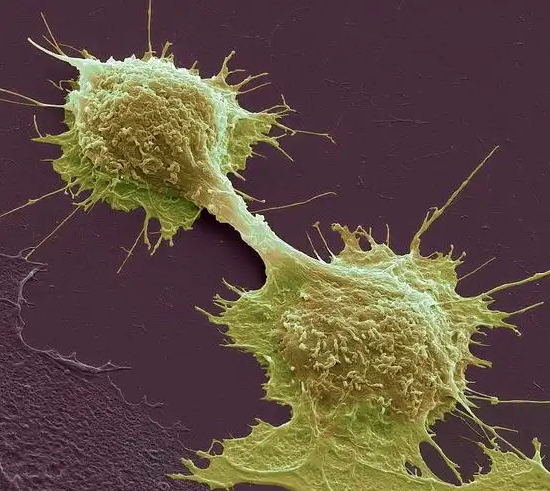
電子顯微鏡下的癌細胞
未竟的征程:癌癥研究的當代挑戰(zhàn)
盡管取得了巨大進展,目前癌癥仍是人類健康的重大威脅。2023年世界衛(wèi)生組織數(shù)據(jù)顯示,全球每年新發(fā)癌癥病例約2000萬,死亡人數(shù)達1000萬。當代研究面臨的核心挑戰(zhàn),恰是鮑維里當年觀察到的“染色體不穩(wěn)定性”的延續(xù)——癌細胞在增殖過程中不斷產(chǎn)生新的突變,形成“腫瘤異質(zhì)性”,就像不斷變異的病毒,使治療藥物很快失效。
為應對這一挑戰(zhàn),科學家正在開發(fā)更精準的治療策略。液體活檢技術通過檢測血液中癌細胞釋放的DNA片段,能實時追蹤腫瘤的突變動態(tài),為調(diào)整治療方案提供依據(jù);單細胞測序技術則能解析腫瘤中不同亞群細胞的遺傳差異,助力個性化治療。此外,針對癌細胞能量代謝異常、血管生成等特性的新型藥物,也在臨床試驗中展現(xiàn)出潛力。
如今,這場跨越百年的科學接力仍在繼續(xù),從顯微鏡下的初步觀察到分子層面的精準干預,人類對癌癥的認知每深入一步,就向戰(zhàn)勝它的目標靠近一分。
參考來源:科學網(wǎng)、中國科普博覽
來源: 江蘇省科學技術協(xié)會


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助

