在上海長征醫院的病房里,一位硬皮病患者正接受最后一次隨訪。曾經僵硬如皮革的皮膚變得柔軟,心肺功能的影像學檢查顯示纖維化病灶明顯逆轉。這不是科幻電影的情節,而是2024年中國科學家用異體CAR-T細胞創造的醫學奇跡。這種源自健康供者的"通用型"免疫細胞,正以革命性的方式重塑自身免疫病的治療格局。
免疫系統的"自我攻擊"是自身免疫病的核心病機。當B細胞錯誤地產生針對自身組織的抗體,系統性紅斑狼瘡、硬皮病等疾病便悄然降臨。傳統療法依賴激素和免疫抑制劑,如同給免疫系統蒙上眼罩,雖能暫時緩解癥狀,卻無法根治疾病,且副作用顯著。CAR-T細胞療法的出現,為這些患者帶來了新希望。這種通過基因編輯賦予T細胞精準識別能力的技術,在癌癥治療中已展現出驚人療效,但自體CAR-T療法的局限性始終制約其普及——每位患者需單獨制備細胞,周期長達兩周,成本高達百萬,且部分患者因免疫系統受損無法完成細胞采集。
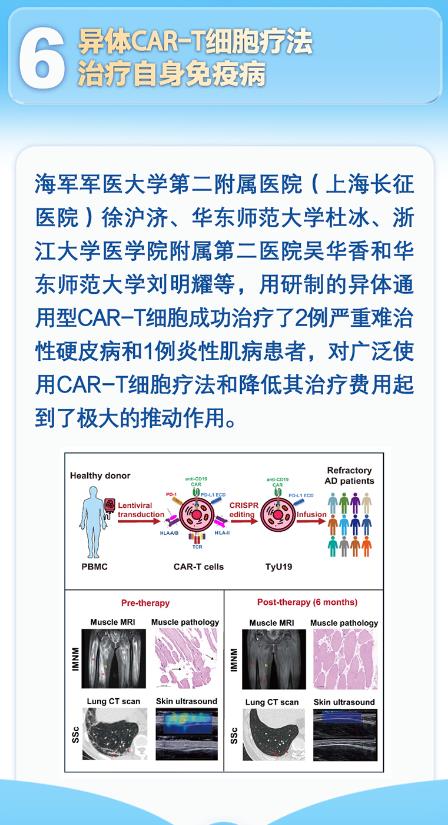
海軍軍醫大學徐滬濟團隊的突破在于創造性地使用健康供者的T細胞,通過基因編輯技術解決異體排斥難題。他們開發的TyU19型CAR-T細胞,如同經過嚴格訓練的"通用士兵",既能精準清除異常B細胞,又避免了移植物抗宿主病(GVHD)的風險。在首批臨床試驗中,兩名硬皮病患者和一名炎性肌病患者接受治療后,皮膚硬度、肌肉力量和器官功能均出現顯著改善,部分患者甚至實現了纖維化逆轉。這種療效突破傳統認知,因為纖維化通常被認為是不可逆的組織損傷。
技術創新的關鍵在于"基因剪刀"的巧妙運用。研究人員通過CRISPR/Cas9技術敲除T細胞受體(TCR)基因,避免異體T細胞攻擊患者正常組織;同時敲除HLA基因,降低宿主免疫系統對供體細胞的識別。這種雙重編輯如同為CAR-T細胞穿上"隱身衣",使其在患者體內存活時間延長至6個月以上,確保持續清除異常B細胞。更令人驚喜的是,這種通用型療法只需一份健康供者的血液,即可制備200份CAR-T細胞,將治療成本降低至自體療法的十分之一。
這種"現貨供應"模式正在改變臨床實踐。在浙江大學醫學院附屬兒童醫院,毛建華團隊用自體CAR-T療法成功治療20例難治性紅斑狼瘡患兒,所有患者癥狀緩解并停用激素。而通用型CAR-T的優勢在兒童患者中尤為顯著——部分患兒因長期使用免疫抑制劑導致T細胞功能受損,自體療法難以實施。如今,健康供者的"優質細胞"成為新選擇,治療周期從數周縮短至數天。
盡管取得重大突破,科學家仍在不斷優化技術。在安全性方面,研究人員通過調整清淋預處理方案,將細胞因子釋放綜合征(CRS)發生率降至15%以下,且所有患者均未出現嚴重神經毒性。針對不同自身免疫病的靶點研究也在展開:靶向CD20的CAR-T細胞已進入類風濕關節炎臨床試驗,而雙特異性CAR-T技術則試圖同時調控B細胞和異常T細胞,為多發性硬化癥等復雜疾病提供解決方案。
站在技術革新的臨界點,我們看到的不僅是醫學的進步,更是生命科學的無限可能。從癌癥治療到免疫修復,CAR-T細胞的跨界應用正在重新定義疾病治愈的邊界。未來,或許每位自身免疫病患者都能像使用抗生素一樣,便捷地接受"通用型"細胞治療,徹底擺脫終身用藥的困擾。這些源自健康供者的"生命種子",終將在患者體內綻放出治愈的希望之花。
來源: 桂粵科普


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 桂粵科普
桂粵科普 
