3D打印技術已經悄然走進了我們生活的各個角落——從房屋建筑到精密的納米制造,它正改變著傳統生產方式。今天,我們要聊聊一項前沿應用:利用納米級3D打印技術,打造能夠精確控制疫苗釋放的黑科技系統。
從宏觀到微觀:3D打印技術的多維應用
大家都知道,3D打印技術可以打印出各種各樣的物品:在大尺度上,可以用來打印房屋;在微尺度上,它甚至可以打印納米和微米級別的部件。尤其在生物醫藥領域,微米級的打印技術正被用于制造精準的疫苗遞送系統。
 圖1. 3D打印房屋(Printerra公司)
圖1. 3D打印房屋(Printerra公司)
傳統疫苗注射的挑戰
目前,大多數疫苗是通過直接肌肉注射來實現免疫應答。這種方式雖然簡單,但也存在不少問題和不足:
1.多次免疫的需求:有些疫苗需要多次注射才能建立起足夠的免疫保護。
2.免疫應答難以控制:注射后,體內的抗原釋放情況無法精確調控,導致產生的免疫應答類型不易把握。例如,如何平衡TH1和TH2型免疫反應,直接影響疫苗的保護效果。
正是因為這些問題,科學家們一直在尋找一種能夠精確控制疫苗釋放速率和持續時間的新方法,而納米級的3D打印技術正為我們提供了全新的解決方案。
納米3D打印技術:打開精準遞送的新大門
隨著二維雙光子聚合(2PP)3D打印技術的不斷發展,我們已經能夠實現納米和微米尺度的高精度打印。例如,德國Nanoscrib公司的多款打印機已具備極高的分辨率,能夠制造出微小而復雜的結構。
然而,要將這種技術應用到疫苗遞送上,還存在一大難題:傳統樹脂往往缺乏生物相容性、快速聚合和可調控的降解動力學。這些特性正是精確控制疫苗釋放所必須的。
 圖2. 納米3D打印機(Nanoscrib公司)
圖2. 納米3D打印機(Nanoscrib公司)
SCRIBE樹脂:帝國學院Molly團隊的創新之作
為了解決這一瓶頸,近期倫敦帝國學院Molly團隊開發出一種全新的、可生物降解的2PP打印墨水——SCRIBE樹脂。該研究以“Nanoscale Biodegradable Printing for Designed Tuneability of Vaccine Delivery Kinetics” 為標題發表于Advanced Materials期刊上。這款優化后的樹脂具有多項突破性優勢:
1.亞微米分辨率打印:SCRIBE樹脂支持極高的打印精度,使得復雜的微結構(如空心微粒)得以制造。
2.快速打印速度:相比傳統2PP方法,SCRIBE樹脂能夠實現更高效的打印,大大提高了生產效率。
3.可調控的溶脹與降解特性:通過改變共聚單體的組成,不僅不會影響打印分辨率,還能精確調整材料的溶脹和降解行為。
4.高丙烯酸酯轉化率和良好生物相容性:其降解產物對人體細胞友好,具有很好的生物安全性。
利用SCRIBE樹脂,研究人員成功設計并制造出結構獨特的空心微粒,這些微粒能夠高效負載抗原蛋白,并實現長期封裝,成為疫苗遞送系統的重要核心部件。
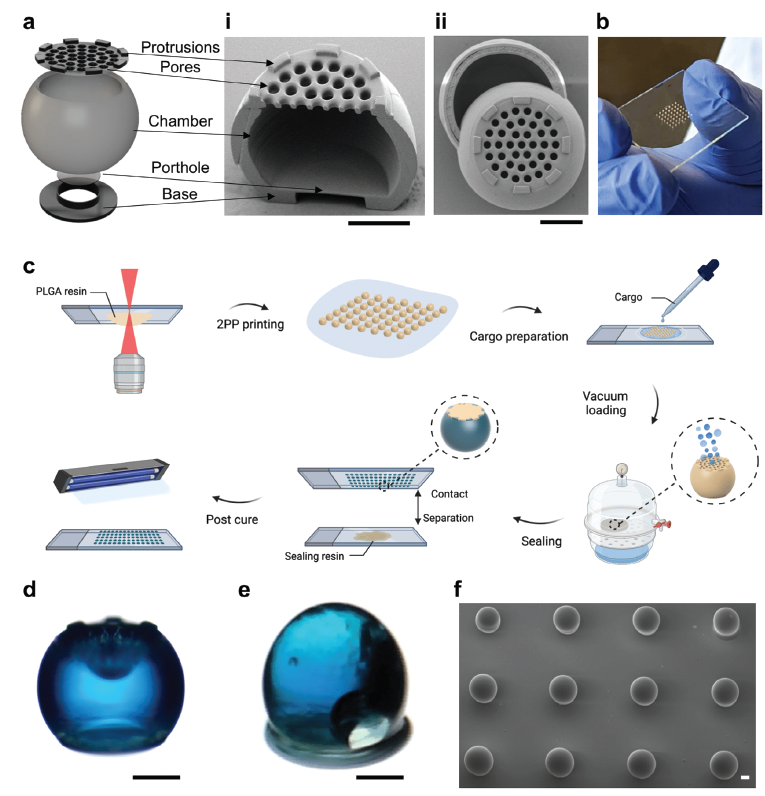 圖3. SCRIBE樹脂中空微粒的設計與微細加工(參考文獻6)
圖3. SCRIBE樹脂中空微粒的設計與微細加工(參考文獻6)
體內實驗:釋放速率與免疫應答的精密調控
實驗結果顯示,SCRIBE顆粒的厚度和化學組成直接影響了疫苗釋放的動力學,持續釋放時間可以從數周延長到數月。小鼠模型體內實驗顯示釋放速率影響免疫反應類型,慢釋放的配方更傾向于誘導TH2相關反應,而快釋放的配方則偏向TH1相關反應。此外,對比傳統的初免-加強免疫方案,1μm大小的NVP顆粒只需單次注射,就能誘導出與雙次注射可溶性疫苗相似的抗體滴度,而且免疫反應啟動更快。更重要的是,SCRIBE顆粒在體內能完全降解或展現出極高的生物相容性。
通過直接激光寫入技術,SCRIBE樹脂不僅實現了對疫苗遞送微粒的精準制造,還成功確定了持續釋放與最大抗體滴度和亞型轉換之間的相關性,為未來的單注射疫苗開發提供了可能性。
 圖4. SCRIBE 技術的單劑疫苗接種效果(參考文獻6)
圖4. SCRIBE 技術的單劑疫苗接種效果(參考文獻6)
展望未來:智能疫苗遞送的新方向
SCRIBE技術的成功為疫苗遞送系統帶來了革命性的改變。通過納米級3D打印技術和SCRIBE樹脂,科學家們正邁出一步,實現疫苗遞送系統的精密控制。這不僅有望簡化免疫程序,降低疫苗接種的次數,還可能帶來更理想的免疫效果,為全球公共衛生事業開辟全新的發展道路。
參考文獻:
1.Kronenfeld, J. M., L. Rother, M. A. Saccone, M. T. Dulay and J. M. DeSimone (2024). "Roll-to-roll, high-resolution 3D printing of shape-specific particles." Nature 627(8003): 306-312.
2.Tran, K. T. M., T. D. Gavitt, N. J. Farrell, E. J. Curry, A. B. Mara, A. Patel, L. Brown, S. Kilpatrick, R. Piotrowska, N. Mishra, S. M. Szczepanek and T. D. Nguyen (2021). "Transdermal microneedles for the programmable burst release of multiple vaccine payloads." Nat Biomed Eng 5(9): 998-1007.
3.Sangesland, M., A. Torrents de la Pena, S. Boyoglu-Barnum, L. Ronsard, F. A. N. Mohamed, T. B. Moreno, R. M. Barnes, D. Rohrer, N. Lonberg, M. Ghebremichael, M. Kanekiyo, A. Ward and D. Lingwood (2022). "Allelic polymorphism controls autoreactivity and vaccine elicitation of human broadly neutralizing antibodies against influenza virus." Immunity 55(9): 1693-1709 e1698.
4.Lavelle, E. C. and C. P. McEntee (2024). "Vaccine adjuvants: Tailoring innate recognition to send the right message." Immunity 57(4): 772-789.
5.Ma, Y. F., K. Chen, B. Xie, J. Zhu, X. He, C. Chen, Y. R. Yang and Y. Liu (2024). "Enhanced Antibody Response to the Conformational Non-RBD Region via DNA Prime-Protein Boost Elicits Broad Cross-Neutralization Against SARS-CoV-2 Variants." Emerg Microbes Infect: 2447615.6.Peeler, D. J., R. Sun, C. Kutahya, P. Peschke, K. Zhou, G. Brachi, J. Yeow, O. Rifaie-Graham, J. P. Wojciechowski, T. F. F. Fernandez Debets, V. LaLone, X. Song, K. Polra, P. F. McKay, J. S. Tregoning, R. J. Shattock and M. M. Stevens (2025). "Nanoscale Biodegradable Printing for Designed Tuneability of Vaccine Delivery Kinetics." Adv Mater: e2417290.
來源: 馬云飛(中國醫學科學院醫學生物學研究所)


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 云兮疫苗科普
云兮疫苗科普 
