
前言概述
/ CONTENTS
學科新知聚焦業內權威專家,從學科發展的高度全面梳理、深入解讀腫瘤醫學各領域的國內外研究現狀與進展,為醫護以及科研人員立體勾勒惡性腫瘤領域的最新研究進展,賦能臨床科研和學術推廣,為醫學研究者搭建一個共享知識、交流經驗的平臺,推動腫瘤醫學領域的國際化合作與發展。
本期學科新知分享的是中南大學湘雅醫院傅敢教授對淋巴瘤臨床前沿進展的精彩解讀。
TP53基因的畸變和p53蛋白通路的失調在許多人類腫瘤的發病機制中很重要,特別是彌漫性大B細胞淋巴瘤。通過調節許多下游靶基因或分子,TP53主要可以抑制腫瘤生長,并促進細胞DNA修復、凋亡、自噬、細胞周期停滯、信號傳導、轉錄、免疫或炎癥反應和代謝。TP53的功能障礙,包括microRNA調控、TP53通路和TP53本身的拷貝數改變、TP53調節因子失調以及TP53功能模式異常導致的體細胞突變,在淋巴瘤的發生、進展和侵襲中起重要作用,具有該突變的彌漫大B細胞淋巴瘤患者的預后往往不佳[1]。本文討論TP53突變對彌漫大B細胞淋巴瘤患者預后的影響,展望未來TP53突變陽性彌漫大B細胞淋巴瘤臨床探索方向,共同推進中國淋巴瘤臨床治療事業的發展!
1
p53蛋白的復雜作用
(1)p53——8億年的進化
人類p53家族包含三個成員p53、p63和p73。TP53基因家族在多細胞動物發育過程中已經進化了6億至8億年,其編碼的p53蛋白及其細胞通路通過對環境擾動的感知、調節,在胚胎發育過程中起著重要作用,通過細胞凋亡等途徑確保多細胞生物各細胞類型間的協調與穩定,有著豐富而強大的功能[2, 3]。
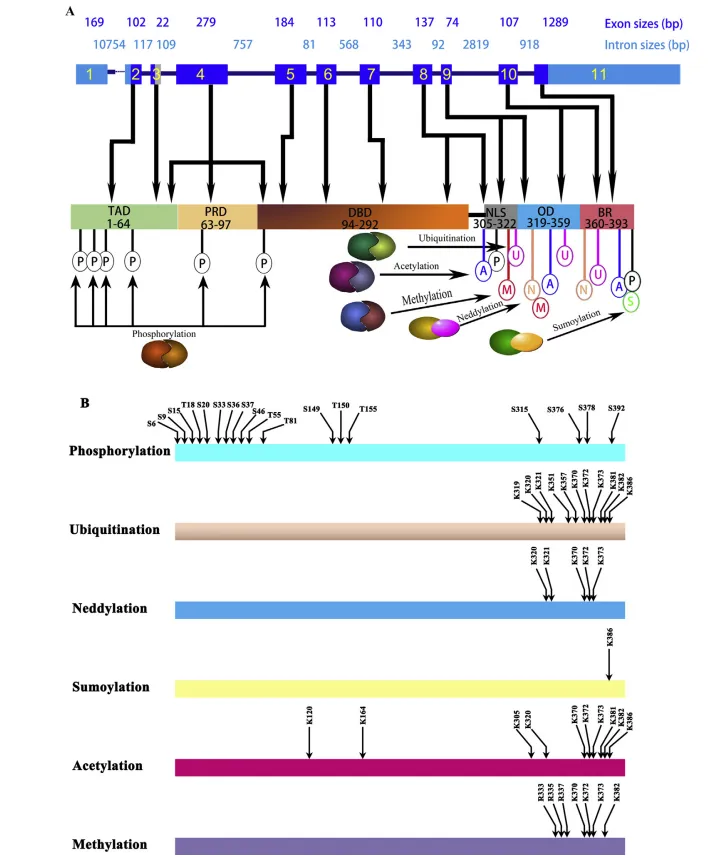
圖1 TP53和p53蛋白的結構[1]
p53可以感知并響應表觀基因組擾動,參與調控發育過程中滿足特定生物學需求基因的表達。例如,DNMT和TET等表觀遺傳調控蛋白對DNA甲基化的嚴格調控就需要p53參與[4]。
p53還可以幫助維持基因組完整性,其中一個機制就是抑制逆轉錄轉座子的活性。LINE-1是目前已知的在人體內唯一能夠自主性轉座的逆轉錄轉座子,其高表達與腫瘤的發生發展密切相關[5, 6]。
p53在DNA損傷修復、誘導細胞衰老和促進細胞凋亡過程中起到關鍵作用。當DNA受損時,p53被激活以促進受損細胞的清除或修復,降低它們突變的積累風險。值得注意的是,p53對于可逆DNA損傷誘導的G1期檢查點至關重要,這主要是通過其轉錄激活p21周期蛋白依賴性激酶抑制劑基因來介導的[5]。
此外,p53在抑制腫瘤血管形成、維持代謝穩態等方面也展示出強大實力[5]。
正是由于p53的多重功能,它被視為“基因組的守護者”,致力于維持多細胞生物體內細胞功能和組織結構的協調性,并在抑制腫瘤方面發揮著巨大潛力[1, 5]。
圖2 p53腫瘤抑制機制的研究[5]
(2)p53調控網絡
p53和MDM2蛋白是該通路中的中心樞紐。在正常細胞中,p53蛋白通過包括MDM2在內的一系列調節因子維持在低水平,MDM2作為p53泛素連接酶,促進其降解,抑制p53下游調控的相關基因表達。細胞環境(細胞類型、表觀遺傳狀態、組織微環境、激活信號)對p53活性的生化方面以及p53反應的生物學結果都至關重要,多種多樣的調控因子控制著p53的活性,而p53反過來又控制著許多不同的生物學過程,其各種功能取決于其控制眾多靶基因中不同組的能力。正因如此,p53嵌入在一個密集且相互連接的調控網絡中[5]。
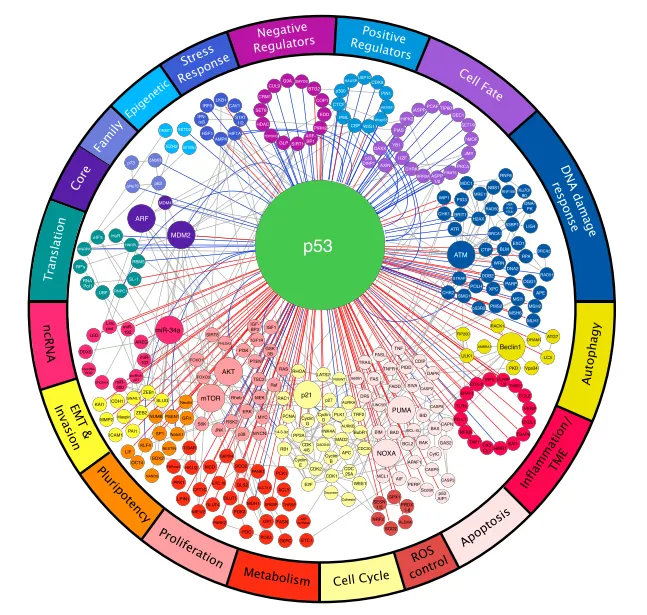
圖3 p53調控網絡[5]
2
TP53突變類型及成藥
p53蛋白具有復雜的功能,TP53位點的改變也具有多樣性。由于TP53突變往往導致p53失活,恢復p53的功能比較困難,因此直接靶向p53被認為是不可成藥的。但是,針對p53調控網絡的靶向治療目前正被廣泛研究。另外,針對p53特定突變的免疫療法、合成致死策略等可能是未來的重要研究方向。
01
TP53突變的多樣性
在TP53基因的改變中,缺失、插入、移碼、錯義和無義突變構成了其主要的發生機制。尤其是錯義突變,它在這些變化中顯得尤為普遍。據研究報道,在多達200余種的人類實體腫瘤中,有大約一半的腫瘤攜帶了TP53基因突變。目前的大部分觀點將p53分為野生型和突變型,但TP53突變是以不同的模式發生的,其在許多等位基因配置中產生多樣的功能和表型分支。例如,野生型功能的衰減可以產生亞型,也可以根據p53抑制的水平產生不可預測的和質量不同的表型。隨著未來臨床決策越來越多地基于基因組數據,簡單地將腫瘤分類為“p53野生型”或“p53突變型”可能會忽略突變的復雜性[5]。
圖4 幾種不同的機制可導致不同的p53突變表型[5]
02
p53相關靶向抗腫瘤藥物治療
在腫瘤治療領域,尋找能夠有效靶向突變p53蛋白的藥物一直是科研人員不懈追求的目標。然而,這一努力卻面臨著不小的挑戰。由于野生型p53蛋白以及大多數突變p53蛋白缺乏明確的結合口袋或變構位點,這使得傳統藥物設計策略難以應用。因此,這些p53蛋白往往被視為“不可成藥的”靶點,盡管如此,科研人員仍在努力探索新的藥物設計思路和技術手段,以期突破這一難題,為腫瘤患者帶來更有效的治療方案。
● 抑制野生型p53蛋白的降解
在保持野生型TP53表達的腫瘤中,最廣泛采用的p53靶向治療方法是抑制p53降解。現有的研究表明,p53的降解機制與E3泛素連接酶MDM2密切相關,MDM2通過使p53泛素化,進而引發p53的蛋白酶體降解。值得注意的是,MDM2的擴增現象在多種癌癥類型中均有發現,尤其常見于保持野生型p53的腫瘤中。MDM2介導的泛素化和降解依賴于它與p53的直接結合,這啟發了科研人員積極尋找能夠抑制MDM2與p53結合的小分子化合物,以此作為穩定p53并恢復其抗腫瘤效力的新手段。例如,APG-115、AMG-232等[7]。
● 靶向截斷的p53蛋白
盡管錯義突變在腫瘤相關的TP53突變中占據多數,但仍有大約10%的TP53突變腫瘤攜帶著無義突變,這些突變導致產生截斷蛋白。這些截斷蛋白由于結構不完整,通常在翻譯后不久便被無義介導的mRNA衰變(NMD)機制所降解。鑒于這些蛋白質的存在時間極短,且往往缺乏完整的p53蛋白序列,研究人員提出了兩種替代策略來激活含有p53截斷突變的癌細胞中的p53信號通路[7]。
第一種策略是通過利用能夠促進翻譯讀通的分子,讓翻譯機制越過RNA中的停止密碼子,從而合成全長p53蛋白。例如,G418、NB124等。另一種互補的策略則聚焦于抑制NMD過程。這兩種方法為TP53無義突變的腫瘤患者提供了新的治療思路[7]。
● 基于p53蛋白的免疫治療
近年來,腫瘤免疫治療方案的突破性進展在多種腫瘤類型中取得了顯著的成果,激發了研究者們對于基于p53免疫治療策略的研究熱情。這些策略的核心目標在于提高免疫系統的識別和清除能力,有望為腫瘤患者提供更加個性化和高效的治療方案,為腫瘤治療領域帶來新的希望和突破。例如,p53疫苗、T細胞受體模擬(TCRm)抗體等[7]。
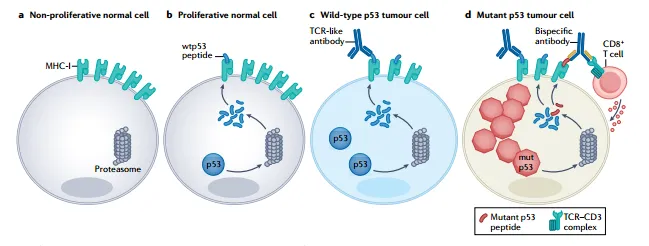
圖5 癌細胞中p53的抗體新策略[7]
● 基于p53蛋白的基因治療
基因治療作為恢復p53功能的關鍵手段,其重要性不容忽視。值得一提的是,首個獲批用于臨床實踐的基因療法便是以p53為基礎,即重組腺病毒人p53(rAd-p53)注射劑Gendicine,用于治療頭頸鱗狀細胞癌(HNSCC)。這一里程碑式的成就不僅彰顯了基因治療在醫學領域的巨大潛力,也為后續更多基于p53的基因療法研究與應用提供了寶貴的經驗[7]。
此外,在非病毒載體遞送策略的設計上,納米技術的巧妙應用顯著提升了基因的轉染效率,增強了其特異性,并改善了生物相容性。非病毒載體的基因類型豐富多樣,其中主要包括寡核苷酸、質粒DNA以及siRNA等。例如,在肝細胞癌小鼠模型中,p53 mRNA納米顆粒聯合免疫治療比單獨治療具有更好的抗癌效果,這一發現為進一步深入探索p53 mRNA與免疫檢查點阻斷治療聯合應用的療效奠定了堅實的基礎[7]。
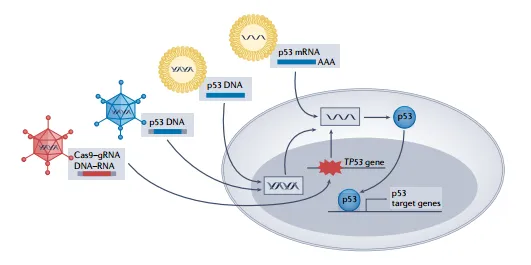
圖6 基于p53蛋白的基因治療[7]
3
彌漫大B細胞淋巴瘤患者中TP53基因異常對預后的影響
彌漫大B細胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤中最常見的類型,具有高度的異質性和高侵襲性。DLBCL的發病過程涉及多種相關基因的異常,這些異常不僅參與了疾病的發生,還深刻影響著患者的預后。
有研究顯示,21.4%的DLBCL患者伴有p53基因突變,其中90.2%為單一核苷酸突變,9.8%為其他突變;TP53功能障礙在DLBCL的發生、發展和進展中的重要作用已獲得大量證據支持。Kaplan-Meier分析結果顯示,p53基因突變患者的預后明顯差于無突變者,是DLBCL患者的獨立預后因素[8]。但是由于TP53基因突變及其突變后功能變異的多樣性、異質性,其對某個具體患者預后影響的分析應該結合該患者TP53基因突變的類型、位點、受影響的靶基因等而進行個體化分析、“case by case”,傳統的簡單根據p53基因變化狀態“野生型或突變型”而籠統地分為 “預后好、預后差”的觀點是不精確的,如在2020年提出的一種DLBCL分子分型中,p53突變對預后的影響在不同分子亞型之間差別很大:在MYD88和bcl?2亞型中,p53突變提示預后不良;在Notch2或SOCS1/SGK1亞型中,p53突變對預后無明顯影響;而在TET2/SGK1亞型中p53突變罕見[9]。
單核苷酸多態性(SNP)作為DNA序列中單個核苷酸變異的遺傳現象,其數量最為豐富。而體細胞單核苷酸變異(SNV)作為SNP的一種具體形式,在腫瘤的發生機制中扮演著關鍵角色。2014年,British Journal of Haematology刊文指出,TP53不同突變體導致患者對R-CHOP響應不同,該研究發現TP53基因rs1625895多態性的G/G基因型與DLBCL患者R-CHOP治療失敗的高概率相關[10]。另一項研究發現,在接受R-CHOP治療的DLBCL患者中,位于TP53 3’-UTR的新發SNV改變了TP53的RNA和蛋白質水平。具體來說,這些新發SNV的存在破壞了miRNA與3’-UTR的結合,降低了miRNA抑制作用,從而增加了p53蛋白水平。然而,新發SNV對DLBCL患者預后的影響取決于TP53 CDS、WT或MUT的狀態。在WT-TP53的情況下,與沒有新發SNV的患者相比,miRNA抑制減少,WT-TP53表達增加,患者預后改善;而在MUT-TP53的情況下,無論是否存在新發SNV,MUT-TP53的表達量都會增加,這可能導致化療耐藥和預后較差。大約50%的DLBCL患者含有3’-UTR新發SNV,預計這些新發SNV會破壞miRNA結合位點。因此,在預測患者治療后的預后方面,相比僅依據TP53狀態進行預測,將新發SNV與TP53狀態綜合考慮能夠提供更為全面和準確的信息[1]。

圖7 miRNA調控TP53對預后的影響[1]
4
伴TP53突變的彌漫大B細胞淋巴瘤患者對不同治療方案的響應
目前DLBCL的標準一線治療方案是6~8周期R-CHOP(利妥昔單抗、環磷酰胺、阿霉素、長春新堿和強的松),對于攜帶TP53基因突變的DLBCL患者而言,由于標準的R-CHOP治療不能克服TP53突變的不良預后,為了改善這部分患者的預后狀況,尋找更為有效的治療方案成為當前研究的重點。
現有數據表明,增加R或周期數作為一種治療強化方式,都不會影響TP53突變患者組的預后。2022年一個意大利的多中心協作組嘗試了增加常規化療強度(DA-EPOCH-R+HD-MTX、未行自體干細胞移植)對雙表達或雙打擊伴TP53基因突變DLBCL患者療效的單臂研究,臨床試驗觀察到增加治療強度后2年OS似乎比既往臨床研究報道的R-CHOP方案2年OS有明顯提高,2年OS可以達到62%,但對比無TP53基因突變(2年OS:88%,P=0.036)仍有顯著差異,提示單純加大常規藥物劑量不能克服TP53基因突變對預后的負面影響[11]。
2021年發表的FIL-DLCL04臨床研究(R-CHOP/R-megaCHOP對比R-CHOP+HDC+ASCT/R-megaCHOP+HDC+ASCT)隨訪72個月后發現5年FFS(TP53 基因突變 vs TP53野生型為24% vs 72%)和5年OS(TP53 基因突變 vs TP53野生型為34% vs 83%),說明在年輕DLBCL患者中,哪怕部分患者接受了自體干細胞移植,TP53基因突變也是一個獨立不良預后因素。這項研究也發現,TP53突變患者與TP53 WT患者相比,接受高劑量化療加自體干細胞移植的強化治療,FFS與OS無差異;但由于此研究實驗設計中并沒有預設TP53 基因狀態分層、同時整體樣本數偏少、TP53 基因突變在整體入組人群中也只占比9%,因此并不能改變自體干細胞移植很可能不能克服TP53基因突變對預后的負面影響的觀點[12]。
由于目前直接針對TP53基因異常的藥物研究進展還未進入臨床,在國內外,諸多臨床研究都積極聚焦于探索如何利用已有的新藥結合不同藥物組合的治療方案以期對TP53突變型DLBCL患者的預后產生積極影響,“R-CHOP+X”方案是其中的一個重要探索點。
由于Phoenix和Robust研究中未設置TP53基因突變亞組分層,目前來說伊布替尼和來那度胺對TP53基因突變的影響尚不明確,但由于這兩個臨床試驗對于non-GCB和/或ABC subtypes DLBCL患者均未獲益,普遍認為前景不樂觀,有可能需要更有效的BTK抑制劑或免疫調節劑來進行專門的臨床試驗。2023年12月ASH年會上,華中科技大學同濟醫學院附屬同濟醫院肖毅教授團隊分享了奧布替尼聯合R-CHOP方案(OR-CHOP)治療初治TP53突變DLBCL患者的單臂研究結果,基于OR-CHOP的方案在TP53突變的DLBCL患者中具有良好的抗腫瘤活性和可控的安全性(12個月PFS率為80.0%,12個月OS率為75.0%)[13]。評判其他新藥(如Bcl-2抑制劑、XPO-1抑制劑、mTOR抑制劑、有絲分裂抑制劑等)是否對TP53基因突變患者預后產生影響的研究也有散在報道,但基本都是小樣本回顧性分析、缺乏大規模前瞻性對照研究,總體上來講結論尚不確定、前景也不樂觀,但借鑒從慢性淋巴細胞白血病和套細胞淋巴瘤臨床試驗中獲得的部分數據,含BTK抑制劑和Bcl-2抑制劑的聯合方案有可能值得關注。
在2021年發表的澳大利亞單中心納入170例接受了CD19-CAR-T治療的難治/復發DLBCL患者的回顧性分析中未發現TP53基因突變對CD19-CAR-T治療療效的影響,這是全球首篇專門研究TP53基因狀態與CAR-T療效關系的臨床研究,作者認為CAR-T治療有可能在一定程度上可以改善難治/復發TP53基因突變DLBCL患者的預后[14]。但在另一個方面,基礎研究已證實p53突變干擾了激活先天免疫反應中細胞質DNA介導的cGAS-STING-TBK1-IRF3的信號傳遞、具有阻斷先天免疫信號通路的活性,從而影響天然免疫信號并促進腫瘤的免疫逃逸[15];可以借鑒的,在CD19-CAR-T治療急性淋巴細胞白血病的研究數據中,TP53基因狀態雖然沒有影響患者30天內疾病CR率,但存在TP53基因突變的患者6個月的OS和PFS顯著低于TP53野生型患者[16]。因此,很多學者認為CD19-CAR-T對難治/復發TP53基因突變DLBCL患者的影響目前尚不能肯定、但很可能也不樂觀。同樣,同為免疫治療,CD20/CD3雙抗是否對TP53基因突變DLBCL患者的預后存在影響目前也不明確。作為一種新興治療方案,免疫治療對這部分患者預后的影響值得進一步研究。
在國內,最新的醫學研究進展也為我們提供了治療TP53突變DLBCL的新策略。2023年10月6日,上海交通大學醫學院附屬瑞金醫院趙維蒞教授和王黎教授共同通訊在Signal Transduction and Targeted Therapy發表一項關于“人內源性逆轉錄病毒(HERV)作為TP53突變的彌漫性大B細胞淋巴瘤的表觀遺傳治療靶點”的研究,該研究評估了667例新診斷DLBCL患者的TP53突變,其中576例接受R-CHOP治療,91例接受地西他濱加R-CHOP治療(DR-CHOP)。研究表明,地西他濱通過SUV39H1-H3K9me3-ERVs軸觸發ERV表達,從而激活干擾素通路,對TP53突變的DLBCL患者進行增敏化療并與R-CHOP協同,表明地西他濱通過調節組蛋白甲基化而具有新的抗腫瘤機制,這些發現進一步為ERVs作為重編程TME治療TP53突變驅動型癌癥的潛在表觀遺傳治療靶點提供了初步臨床依據[17]。廈門大學附屬第一醫院徐兵教授也于2023年11月22日開展一項“阿扎胞苷聯合R-CHOP(AR-CHOP)治療TP53突變且未經治療的彌漫性大B細胞淋巴瘤的單臂臨床研究(NCT06158399)”,該Ⅱ期研究目前正處于入組階段,預計2025年5月達到主要研究終點[18]。
臨床上存在著的一個顯著的問題是,TP53突變型血液腫瘤對通過DNA損傷來誘導癌細胞死亡的細胞毒性藥物展現出更強的耐藥性,同時,這類腫瘤在代謝、基因組穩定性和自噬等方面也存在著缺陷,這些因素共同降低了它們對多種抗癌藥物的敏感性。ADC藥物由于提高了治療窗口(如Pola攜帶的MMAE抗微管作用是長春新堿的1000倍),其臨床使用是否有可能對TP53基因突變患者的預后產生影響?2022年1月,POLARIX研究結果在The New England Journal of Medicine公布:在既往未經治療的DLBCL患者中,與R-CHOP相比,Pola-R-CHP治療顯示出顯著PFS獲益[19],但臨床試驗并未預設TP53基因突變亞組,因此,其對TP53基因突變患者的預后影響尚待后續分析。
5
伴TP53突變淋巴瘤的一種有希望的臨床治療新思路及未來展望
在過去十年中,由于分子譜分析和新治療方法的進步,血液腫瘤的整體生存率有了顯著提升。然而,TP53缺陷性淋巴瘤和白血病依然構成了一個嚴峻的臨床難題。TP53突變在急性髓性白血病(AMLs)和非霍奇金淋巴瘤(NHLs)中發生率高達25%,在自然殺傷/T細胞淋巴瘤(NK/T)中更是高達60%。鑒于這些嚴峻的數據,當前迫切需要研發出針對TP53突變血液腫瘤的有效治療方法,以改善患者的預后和生活質量[20]。
早在2013年9月,Blood上就有臨床研究利用煙酰胺(Sirtuin抑制劑)和脫乙酰酶(DAC)抑制劑(伏立諾他)協同聯合治療復發/難治性DLBCL細胞株的體外實驗,研究發現Sirtuin和DAC抑制劑聯合治療DLBCL可導致協同細胞毒性和BCL6和p53的乙酰化。伏立諾他聯合煙酰胺治療的復發性淋巴瘤患者的總有效率為24%,另有57%達到疾病穩定,表明該治療方案在臨床上具有一定的活性[21]。
由于TP53基因在生理病理過程中的重要作用及其突變后致病機制的復雜性,p53研究領域還有很多未解之謎。這是目前為止研究者已經開發的用來增強或恢復野生型p53功能的一些思路和前期方法、部分研究成果。
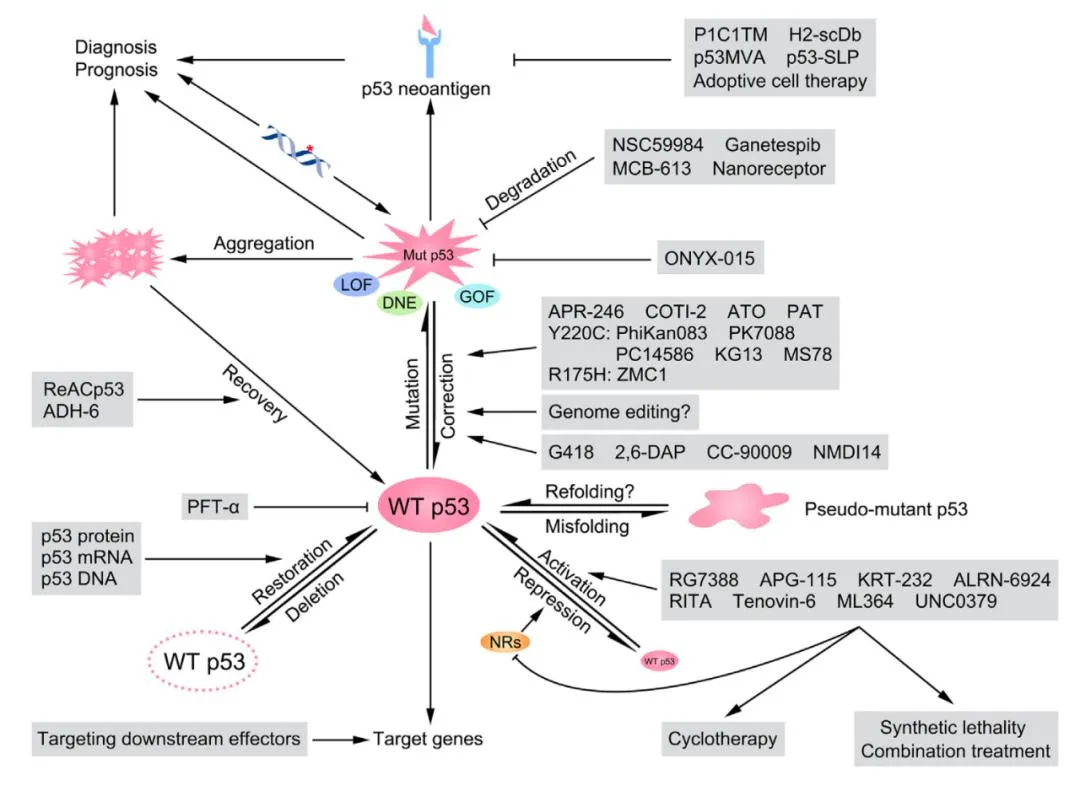
圖8 靶向p53[2]
不久前,來自澳大利亞的研究團隊在Caner Cell上發表了一篇文章,文章指出,通過BH3模擬物誘導的MOMP可以激活p53,進而促進血液腫瘤細胞的凋亡。同時,STING通路的激活則能觸發血液腫瘤中p53非依賴性的細胞凋亡。更值得一提的是,當STING激動劑與BH3模擬物聯合使用時,它們能夠協同作用,有效殺死TP53突變的血液腫瘤細胞[20]。這一發現為我們提供了一條新的治療思路:通過聯合使用BH3模擬物和STING激動劑,可以促進TP53/TRP53野生型和TP53/TRP53突變型白血病和淋巴瘤的細胞凋亡。
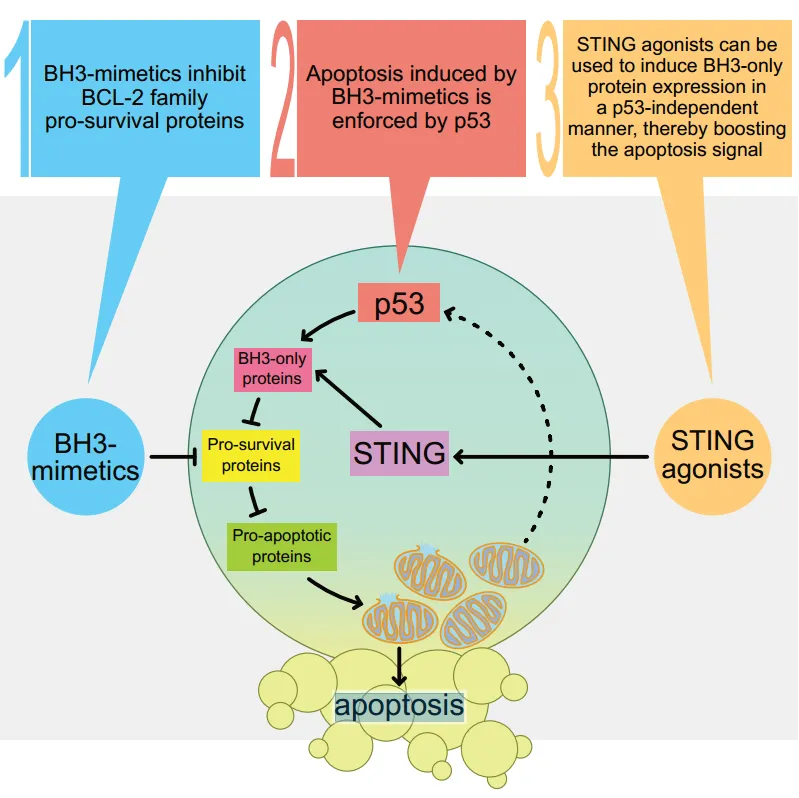
圖9 聯合使用BH3模擬物和STING激動劑治療TP53突變型血液腫瘤[20]
TP53相關的基礎研究和臨床研究目前仍任重道遠。

參考文獻(向上滑動閱覽)
[1]Lu TX, Young KH, Xu W, Li JY. TP53 dysfunction in diffuse large B-cell lymphoma[J]. Crit Rev Oncol Hematol, 2016, 97: 47-55.
[2]Liu Y, Su Z, Tavana O, Gu W. Understanding the complexity of p53 in a new era of tumor suppression[J]. Cancer Cell. 2024, 42(6): 946-967.
[3]Levine AJ. p53: 800 million years of evolution and 40 years of discovery[J]. Nat Rev Cancer, 2020, 20(8): 471-480.
[4]Du W, Xu A, Huang Y, et al. The role of autophagy in targeted therapy for acute myeloid leukemia[J]. Autophagy, 2021, 17(10): 2665-2679.
[5]Kastenhuber ER, Lowe SW. Putting p53 in Context[J]. Cell, 2017, 170(6): 1062-1078.
[6]Liu Q, Wang JH, Li XY, et al. The connection between LINE-1 retrotransposition and human tumorigenesis[J]. Hereditas. 2016, 38(2): 93-102.
[7]Hassin O, Oren M. Drugging p53 in cancer: one protein, many targets[J]. Nat Rev Drug Discov, 2023, 22(2): 127-144.
[8]王書楠, 白鷗. 彌漫大B細胞淋巴瘤臨床預后系統與分子預后因素的研究進展[J].中華血液學雜志, 2016, 37(6): 538-541.
[9]Lacy SE, Barrans SL, Beer PA, et al. Targeted sequencing in DLBCL, molecular subtypes, and outcomes: a haematological malignancy research network report[J]. Blood, 2020, 135(20): 1759-1771.
[10]Voropaeva EN, Voevoda MI, Pospelova TI, et al. Prognostic impact of the TP53 rs1625895 polymorphism in DLBCL patients[J]. Br J Haematol, 2015, 169(1): 32-5.
[11]Dodero A, Guidetti A, Marino F, et al. Dose-adjusted EPOCH and rituximab for the treatment of double expressor and double-hit diffuse large B-cell lymphoma: impact of TP53 mutations on clinical outcome[J]. Haematologica, 2022, 107(5): 1153-1162.
[12]Chiappella A, Diop F, Agostinelli C, et al. Prognostic impact of TP53 mutation in newly diagnosed diffuse large B-cell lymphoma patients treated in the FIL-DLCL04 trial[J]. Br J Haematol, 2022, 196(5): 1184-1193.
[13]Yi Xiao, Jiaying Wu, Mi Zhou, et al. Orelabrutinib Plus R-CHOP Regimen in Treatment-Na?ve Patients with TP53-Mutated Diffuse Large B-Cell Lymphoma (DLBCL)[J]. Blood, 2023, 142(Supplement 1): 6289.
[14]Porpaczy E, Wohlfarth P, K?nigsbrügge O, et al. Influence of TP53 Mutation on Survival of Diffuse Large B-Cell Lymphoma in the CAR T-Cell Era. Cancers (Basel)[J]. 2021, 13(22): 5592.
[15]Ghosh M, Saha S, Bettke J, et al. Mutant p53 suppresses innate immune signaling to promote tumorigenesis[J]. Cancer Cell, 2021, 39(4): 494-508.e5.
[16]Shah NN, Lee DW, Yates B, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL[J]. J Clin Oncol, 2021, 39(15): 1650-1659.
[17]Fang Y, Wang L, Zhao WL, et al. Human endogenous retroviruses as epigenetic therapeutic targets in TP53-mutated diffuse large B-cell lymphoma[J]. Signal Transduct Target Ther, 2023, 8(1): 381.
[18]National Library of Medicine. AZA Combined With RCHOP in P53-mutated DLBCL(NCT06158399)[EB/OL].(2023-12-11).https://www.clinicaltrials.gov/.
[19]Tilly H, Morschhauser F, Sehn LH, et al. Polatuzumab Vedotin in Previously Untreated Diffuse Large B-Cell Lymphoma[J]. N Engl J Med, 2022, 386(4): 351-363.
[20]Diepstraten ST, Yuan Y, La Marca JE, et al. Putting the STING back into BH3-mimetic drugs for TP53-mutant blood cancers[J]. Cancer Cell, 2024, 23: S1535-6108(24)00128-4.
[21]Amengual JE, Clark-Garvey S, Kalac M, et al. Sirtuin and pan-class Ⅰ/Ⅱ deacetylase (DAC) inhibition is synergistic in preclinical models and clinical studies of lymphoma[J]. Blood, 2013, 122(12): 2104-13.
來源: CACA前沿


 科普中國公眾號
科普中國公眾號
 科普中國微博
科普中國微博

 幫助
幫助
 樂問醫學
樂問醫學 